Кавитационная эрозия 5 страница
Неіржавіючі сталі володіють високою хімічною стійкістю в агресивних середовищах. Найбільш поширені з цієї групи - хромисті (13—30 % Сг), хромонікелеві (до 10—12 % Ni), хромонікельмолібденові сталі. Термін «неіржавіючі сталі» умовний і не припускає абсолютну стійкість цих матеріалів в агресивних середовищах. Так, пасивованість ( пассивируемость), а отже, і корозійна стійкість хромистих сталей зростає із збільшенням окисних властивостей середовища, їх електродні потенціали стають ще позитивнішими, проте при збільшенні концентрації нітратної кислоти корозія хромистих сталей інтенсифікується із-за настання перепасивації(мал. 68). При вмісті хрому в сталі >25 % системи Fе—С—Сr стійкі в «царській горілці» і в 30 %-му розчині хлориду заліза (II). В розбавлених розчинах сульфатної і хлоридної кислот хромисті сталі нестійкі, оскільки в неокисних середовищах захисна пасивна плівка не утворюється. Сульфітна і органічні кислоти (мурашина, винна, щавлева), особливо при нагріванні руйнують ці сплави.
В розбавлених лужних розчинах хромисті стали при звичайних температурах стійкі, але при підвищенні температури у концентрованих розчинах і розплавах лугів вони малостійкі.
|
Хромисті сталі схильні до міжкристалітної корозії, що пов'язане з випаданням по межах зерен, багатих хромом, карбідів і збідненням хромом твердого розчину. Міжкристалітна корозія - це один з різновидів структурної корозії сплавів. При контакті поверхні сплаву з електролітом структурні складові сплаву кородують з різною швидкістю, яка визначається електрохімічними властивостями, величиною потенціалу і складом корозійного середовища.
Міжкристалітна корозія виникає за наступних умов:
а) структурна складова, що розташована по межах зерен кристалітів, кородує в активному стані з більшою швидкістю, а тіло зерна знаходиться в пасивному стані;
б) структурна складова розташована у вигляді безперервного ланцюжка по межах зерен кристалітів.
Характер анодних поляризаційних кривих для тіла зерна (крива 1) і структури меж зерен (крива 2) показаний на мал. 69. Максимальна швидкість міжкристалітної корозії спостерігається при потенціалі, рівному φ
Для неіржавіючих сталей міжкристалітна корозія викликана утворенням зони, збідненої хромом, по межах зерен кристалітів, із-за виділення карбідів хрому, фериту або інтерметалевої сполуки FеСr при відпуску загартованої сталі.
Основний спосіб захисту сплавів від міжкристалітної корозії - раціональне їх легування у поєднанні з оптимальним режимом термічної обробки.
Міжкристалітну корозію хромистих сталей можна подавити легуванням їх титаном, ніобієм. Хромисті сталі піддаються різним видам механічної обробки: литво, штампування, прокат.
Неіржавіючі стали як конструкційний матеріал широко використовують в хімічній, нафтопереробній, харчовій промисловості і як декоративний матеріал - в архітектурі і автомобілебудуванні. Крім того, вони застосовуються для виготовлення ріжучих інструментів, штампів, лопаток парових турбін.
Сплави залізоникелів не застосовуються як конструкційні матеріали, оскільки вони не мають особливих переваг порівняно з хромистими сталямі, тому часто використовують сталі на основі системи Fе — Cr — Ni — С. Введення нікелю змінює структуру і позитивно впливає на властивості сплаву (подрібнює зерно). У лугах корозійна стійкість сплавів Fе — Ni дуже висока при вмісті нікелю вище 30 %. Сплави, що містять 50—80 % Ni, відрізняються високою стійкістю в плавиковій кислоті. Хромонікелеві сталі поєднують високу пластичність і в'язкість з достатньою міцністю і жароміцністю. Міцність їх можна значно збільшити шляхом холодної деформації, наприклад межа міцності сталі підвищується з 550 до 1180 МПа, межа текучості - з 200 до 1100 МПа. Найкращі показники відносно механічних властивостей мають хромоні-келеві сталі із вмістом вуглецю від 0,10 до 0,15 %.
Високолеговані хромонікелеві сталі стійкі в нітратній кислоті при концентраціях не вище 80 % і температурі до 70°С, а в хлоридній кислоті нестійкі. У фосфорній кислоті стійкі при температурі до 100°С і концентрації не вище 60 %. Хромонікелеві сталі достатньо стійкі також в більшості органічних сполук (кислоти, спирти і ін.), в розчинах нітратів, сульфатів і хлоридів, в сухому хлорі і сірчистому газі, в оксидах азоту, сірководні, оксиді вуглецю (II). При високих концентраціях розчинів азотної кислоти хромонікелеві стали, так само як і хромисті, із-за переходу хрому в оксиди вищого ступеня окиснення перепасивуються, і пасивні плівки втрачають захисні властивості.
Для підвищення стійкості хромонікельовой сталі в неокисляючих середовищах як легуючі присадки вводять молібден, мідь, кремній і ін. Так, хромоникельмолібденові сталі(10Х17Н13М2Т, 10Х17Н13М3Т), що містять 2-3% молібдену, поєднують порівняно високу міцність з дуже високими пластичними властивостями і високою ударною в'язкістю. Ці сталі добре зварюються, протягуються і штампуються. Сталі, що містять молібден, схильні до пасивації як в окисних, так і у відновних середовищах і в середовищах з хлорид-іонами.
Хромонікельмолібденові сталі застосовують для виготовлення апаратури, що працює в сильно агресивних середовищах, наприклад в 10-12 %-них розчинах сульфатної кислоти при 40—50°С у гарячих розчинах сульфітної і фосфорної кислот, в киплячих розчинах оцтової, щавлевої і мурашиної кислот.
Корозійна стійкість хромоникельмолібденомідних сталей в деяких агресивних середовищах дуже велика, наприклад в розчинах сульфатної кислоти до 80 %. Такі сталі широко використовують в хімічній, целюлозній, харчовій, автомобільній і інших галузях промисловості.
Жаростійкість- це здатність матеріалу протистояти корозійному руйнуванню під дією повітря або інших газів при високих температурах. До жаростійких сталей відносяться сплави, що містять алюміній, хром, кремній. Такі сталі не утворюють окалини при високих температурах. Наприклад, хромиста сталь, що містить 30 % Сг, стійка до 1200°С. Вплив змісту хрому на жаростійкість стали із змістом вуглецю 0,5 % показано на мал. 70. Введення невеликих добавок алюмінію різко підвищує жаростійкість хромистих сталей. Стійкість таких матеріалів при високих температурах пояснюється освітою на їх поверхні щільних захисних плівок, що складаються головним чином з оксидів легуючих елементів (хром, алюміній, кремній).
Жаростійкі сталі використовують як конструкційний матеріал при виготовленні різних деталей нагрівальних пристроїв і енергетичних установок.
Під жароміцністюрозуміють здатність матеріалу витримувати механічні навантаження без деформацій при певних підвищених температурах. До жароміцних відносяться сталі, що містять хром, кремній, молібден, нікель і ін. Вони зберігають свої прочностниє властивості при нагріві до 650°С і більш. З таких сталей виготовляють нагрівальні елементи теплообмінної апаратури, деталі, казанів, впускні і випускні клапани автомобільних, тракторних, поршневих двигунів.
КОРОЗІЙНА СТІЙКІСТЬ ЛЕГОВАНИХ ЧАВУНІВ
Висококремнисті чавуни - це сплави заліза з кремнієм (Fе — С—Si), що містять 14-18% кремнію. Вони мають хорошу корозійну стійкість в агресивних середовищах. Різке посилення корозійної стійкості характерне для сплавів із змістом кремнію вище 14,5 %.
У Україні поширені дві марки залізокремністих сплавів: С-15 (0,5—0,8 % С; 14,5—15,0 % 31) і С-17 (0,3-0,8 % С; 16,0—18,081). Цим сплавам властиві висока твердість, крихкість; їх не можна прокатувати і обробляти різанням. Виготовлення апаратури або окремих вузлів і деталей з таких сплавів можливо тільки литвом.
Сплави типу С-15 і С-17 вельми чутливі до різких перепадів температур і не витримують швидкого або місцевого нагріву. Корозійна стійкість цих сплавів вельми висока, особливо в розчинах кислот (наприклад, швидкість корозії сплаву С-17 в 40 %-ній Н2S04 менше 0,5 мм/рік, а в 60-94 %-них розчинах Н2S04 — менше 0,025 мм/рік). Ці сплави стійкі в концентрованій азотній кислоті при кипінні, в розчинах фосфорної кислоти всіх концентрацій при будь-яких температурах.
Висока корозійна стійкість железокремністих сплавів обумовлена освітою на їх поверхні захисних пасивних плівок або SiO2 (при концентрації Si у сплаві більше 16 %), або що складається в основному з оксидів заліза. При механічному пошкодженні плівка під дією окисників здібна до «самоутворення». В розчинах фтористоводневої кислоти і концентрованих розчинах лугів захисна плівка не утворюється і сплави типу Fе —С — Si у цих середовищах руйнуються.
Легування залізокремністих сплавів молібденом (2-5 %) збільшує його стійкість в гарячій сульфатній і хлоридній кислотах. Основні області застосування цих сплавів - виготовлення різної замочної арматури, відцентрових насосів і апаратури для роботи з агресивними рідинами.
Хромисті і нікелеві чавуниволодіють високими механічними властивостями, так для Х-28 межа міцності при вигині 570- 650 МПа, твердість за Брінеллю 220—270. Ці сплави володіють задовільними ливарними властивостями. Мінімальний вміст хрому в корозійностійкому чавуні можна розрахувати за формулою:
% Сг = (% С•10) + 12.
Деякі хромисті чавуни після відпалу можуть піддаватися холодній обробці різанням. Добавки кремнію (1-2 %) також покращують механічну оброблюваність хромистих чавунів.
Хромисті чавуни стійкі в розчинах азотної кислоти будь-якої концентрації при нормальних температурах, в розчинах сульфатної (до 62%), фосфорної (до 70%), оцтовою кислотах, в розчинах солей, але в хлоридній кислоті вони руйнуються. Застосовуються хромисті чавуни для виготовлення хімічної апаратури, труб, деталей насосів і так далі.
Характерною особливістю нікелевих чавунів є їх висока корозійна стійкість в розплавах солей і концентрованих розчинах лугів. Нікелеві чавуни з кулястими включеннями графіту застосовують для виготовлення випускного колектора в двигунах внутрішнього згорання, де у зв'язку з високою температурою вихлопних газів створюються умови для інтенсивної газової корозії (зовнішнього і внутрішнього окислення чавунів).
|
КОРОЗІЯ КОЛЬОРОВИХ МЕТАЛІВ І СПЛАВІВ НА ЇХ ОСНОВІ
1. АЛЮМІНІЙ І ЙОГО СПЛАВИ
Стандартний електродний потенціал алюмінію E(А1 /А13+ )= — 1,66 В. Можна припустити, що алюміній вельми активний метал, проте практично він володіє достат-ньо високою корозійною стійкістю в багатьох агресивних середовищах, оскільки на поверхні металу утворюється захисна оксидна плівка. Така плівка з'являється майже миттєво при зіткненні свіжого зрізу металу з повітрям, але зростання її продовжується поволі. Товщина плівки залежить від багатьох умов: для алюмінію, що зберігається в приміщенні, вона складає 0,01-0,02 мкм, при дії сухого кисню - від 0,02 до 0,04 мкм, а при термічній обробці металів доходить до 0,1 мкм.
Залежно від умов поверхнева плівка складається з аморфного або кристалічного оксиду алюмінію або з гідроксиду алюмінію. Вона володіє хорошим зчепленням і задовольняє умові суцільності. Таким чином, алюміній стійкий у всіх середовищах, де на його поверхні утворюється захисна плівка, і нестійкий там, де ця плівка руйнується або немає умов для її формування. Захисна плівка на алюмінії може утворюватися навіть за відсутності окисників; вода, водні розчини нейтральних солей пасивують поверхню алюмінію.
Корозійна стійкість алюмінію визначається багатьма чинниками: природою агресивного середовища, і її концентрацією, температурою, а також впливом цих чинників на можливість формування захисної плівки на поверхні металу і її розвиток. Плівка оксиду алюмінію володіє настільки високими захисними властивостями, що основне завдання легування алюмінію - підвищення механічної міцності, а не хімічної стійкості.
У звичайній атмосфері алюміній стійкий і може застосовуватися без особливого захисту. У промисловій атмосфері алюміній кородує і вимагає спеціального захисту. У сильнокислих і сильнолужних середовищах оксидна плівка на поверхні металу руйнується і корозія зростає.
В окремих випадках алюміній проявляє виняткову стійкість в концентрованих кислотах, наприклад в нітратній кислоті високих концентрацій стійкість алюмінію вища, ніж у неіржавіючих сталей.
Рис. 71. Залежність швидкості корозії від концентрації азотної кислоти: 1-для алюмінію; 2-длясталі Х18Н19
|
Тому алюміній застосовують для апаратурного оформлення процесів виробництва міцної нітратної кислоти методом прямого синтезу
Найбільш небезпечні для алюмінію розчини сульфатної кислоти середніх концентрацій. У концентрованій кислоті і у високопроцентному олеумі при 200°С алюміній достатньо стійкий. Зниження швидкості корозії в кислотах вищої концентрації пов'язують із зменшенням концентрації водневих іонів, з утрудненістю дифузії продуктів реакції з поверхні металу, з можливим пасивуванням. Стійкість алюмінію в розчинах кислот збільшується з підвищенням його чистоти.
Галогеноводневі кислоти інтенсивно взаємодіють з алюмінієм. Ступінь їх агресивності знижується в ряду: НF — НС1 — НВг — HI. У фосфорній і оцтовій кислотах при кімнатній температурі алюміній достатньо стійкий, а мурашина, щавлева і хлорорганічні кислоти його руйнують.
В лужних розчинах оксидна плівка алюмінію легко розчиняється за схемою
Al2O3 + 2NaOH =2NaAl2O2 + H2O
Тільки в слабких розчинах лугів і у водних розчинах аміаку алюміній стійкий. До розплавів лужних металів алюміній стійкий при температурах до 300°С. Ртуть і розчини її солей утворюють з алюмінієм амальгаму, руйнуючи при цьому метал. Газові середовища, що містять сірководень, пари сірки, сухий хлороводень і газоподібний аміак, на алюміній не діють.
Серйозні руйнування алюмінію викликають хлоровмісні органічні розчинники, наприклад ССl4:
2А1+6СС14= 3С2С16 + 2А1С13
Алюмінієві сплави володіють меншою корозійною стійкістю, чим чистий алюміній. Особливо невисокою стійкістю володіють сплави алюмінію з міддю (дюралюміній).
Такі сплави схильні до міжкристалітної корозії. При використанні дюралюмінію в якості конструкційного матеріалу для роботи в агресивних середовищах необхідно приймати захисні заходи. Зазвичай дюралюміній плакуютьтехнічно чистим алюмінієм, при цьому здійснюється одночасно і механічний, і електрохімічний (алюміній - анод по відношенню до сплаву) захист сплаву.
Сплави алюмінію з кремнієм (силуміни) володіють хорошою корозійною стійкістю в агресивних, особливо в окисних середовищах. Висока стійкість силумінів пояснюється утворенням на поверхні захисної плівки, що складається з Al2O3 і SiO2. Луги і плавикова кислота руйнують ці захисні плівки:
Al2O3 + 2NaOH = Na2O ∙ Al2O3 + H2O
SiO2 + NaOH = Na2O ∙ SiO2 +2Н2O
Вид корозійного руйнування визначає можливість втрати міцності сплаву алюмінію. Контакт алюмінію і його сплавів з іншими металами може викликати інтенсивну корозію, особливо в розчинах електролітів або у вологій атмосфері, оскільки в більшості інші метали - катоди по відношенню до алюмінію. Особливо небезпечний для алюмінію і його сплавів є контакт з міддю, сплавами міді і неіржавіючими сталями.
Значний вплив на корозійну стійкість алюмінію роблять домішки. Так, домішка заліза (більше 0,01 %) викликає виділення сполук типу FеАl3 у вигляді крихких кристалітів, що не тільки погіршує пластичність металу і його обробку, але і інтенсифікує корозійний процес навіть в нейтральних середовищах і атмосфері. Електродний потенціал алюмінію менше потенціалу FеАl3, тобто в електрохімічній парі А1 — FеАl3 , алюміній - анод і піддається руйнуванню.
МІДЬ І СПЛАВИ
Стандартний електродний потенціал міді рівний E0( Cu2+/Cu0) = 0,34 B
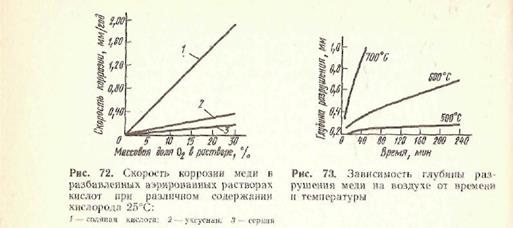
E0(Cu+/Cu0) = 0,52 B . У відсутності окисників мідь володіє хорошою стійкістю у водних розчинах і за звичайних умов не витісняє гідроген з кислот. Первинні продукти корозії , що утворюються при руйнуванні міді, - катіони Cu+и Cu2+ — здатні утворювати комплексні іони типу [СuС12]- , [Сu(NН3)4]+, [Сu(NН3)4]2+ і т. д. Наприклад, мідь інтенсивно руйнується в агресивних аміачних і ціаністих розчинах з утворенням, комплексних іонів типу [Сu(NН3)4]2+ або[Сu(СN)4]3-. Мідь не розчиняється в неокисних кислотах (в розбавленій сульфатній кислоті, в хлоридній, оцтовій кислоті). Проте в реальних умовах, на повітрі, мідь руйнується навіть слабкими кислотами (мал. 72). На швидкість корозії міді в цих умовах окрім температури істотно впливає швидкість руху електроліту.
З концентрованими сірчаною і азотною кислотами мідь інтенсивно взаємодіє:
Сu + 2Н2SO4 → СuSO4 + SO2 + 2Н2O
ЗСu + 8HNО3 →3Сu(NО3)2 +2NO2 +4Н2O
В розбавлених холодних розчинах лугів мідь достатньо стійка, і з неї можна виготовляти апаратуру для зберігання лужних розчинів. Виняток становлять аміачні розчини.
Корозія міді в розчинах солей залежить від природи аніона солі, рН розчину і присутності окисників. В нейтральних неаерованих розчинах мідь стійка, але наявність кисню в розчині провокує корозію. У морській воді мідь стійка, проте при доступі кисню корозія посилюється.
В атмосферних умовах мідь відносно стійка внаслідок утворення на її поверхні захисної плівки, що складається з нерозчинної сполуки СuСO3•Сu(ОН)2. Присутність у вологій атмосфері SО2, НС1, С12 різко інтенсифікує корозію міді, оскільки плівки основної солі , що утворюються: СuС12•3Сu(ОН)2 або СuSО4•3Сu(ОН)2 не володіють захисними властивостями.
В газових середовищах, що містять хлор, бром, йод, пари сірки, оксид вуглецю (IV), мідь руйнується. Технічні сорти міді інтенсивно руйнуються під дією водню при високих температурах. Причиною цього виду корозії (мал. 73)-«водородної крихкості міді» - є взаємодія оксиду міді (I), завжди присутнього в технічних сортах міді, з воднем за реакцією
Сu2O + Н2 = 2Сu + Н2О
Пари води руйнують зв'язок між кристалітами в металі, що приводить до появи тріщин.
Корозійна стійкість сплавів на основі міді визначається їх хімічним складом. Так, олов'яна бронза вище за своєю корозійною стійкістю, ніж мідь, в таких агресивних середовищах, як розбавлені розчини сульфатної та інших мінеральних кислот, лужні розчини (виключаючи аміачні), в морській воді. З підвищенням вмісту олова в сплаві стійкість бронзи збільшується. Проте в нітратній кислоті і інших окисниках, в розчинах ціаністих сполук ці сплави нестійкі. З підвищенням температури стійкість олов'яної бронзи знижується.
Алюмінієва бронза стійка в розбавлених розчинах мінеральних кислот, що не є окисниками (у хлоридній, фосфорній) і у ряді органічних кислот. Найкращими корозійними властивостями відрізняється бронза, що містить 9,8 % алюмінію і 4 % заліза, а при введенні в сплав 4-6 % нікелю матеріал набуває стійкості до газової корозії до 500°С.
Крем'яниста бронза стійка в 92 %-ній сульфатній кислоті при температурах до 50°С.
Проста латунь володіє меншою корозійною стійкістю, ніж мідь. Складна латунь, що містить марганець, хром, по своїй корозійній стійкості не поступається міді. Для латуні характерні такі види корозійних руйнувань, як знецинковання і корозійне розтріскування. Суть процесу знецинковання в тому, що при розчиненні латуні в нейтральних або слабокислих середовищах в розчин переходять іони цинку, а на катодних ділянках поверхні сплаву накопичується мідь. Продукти корозії цинку можуть накопичуватися або затримуватися на поверхні сплаву у вигляді шару. Процесу корозії сприяють високий вміст цинку в сплавах, аерація і перемішування електроліту, наявність хлорид-іонов в розчині, підвищений вміст міді в розчині, контакт сплаву з більш електропозитивними металами. Основною мірою захисту від оцин-кування може служити додаткове легування сплаву, зокрема миш'яком (до 0,03 %), сурьмою, фосфором або оловом (до 1 %).
Вміст миш'яку (0,01 %) запобігає знецинкованню латуні (Л70) в морській воді при 50°С.
Корозійне розтріскування - процес, пов'язаний з наявністю у виробах після обробки внутрішньої напруги. Такі руйнування є результатом одночасно дії на метал міжкристалітної корозії і внутрішньої напруги. Додаткове легування латуні кремнієм (до 1 %) знижує корозійне розтріскування. Іншою мірою попередження може служити попередня термічна обробка виробу.
ТИТАН І ЙОГО СПЛАВИ
Стандартний електродний потенціал титану рівний E0(Ti2+\ Ti0) = -1.63 В, і
E0(Ti3+\ Ti0) = -1,21 В, це - хімічно активний елемент. Інертність титану при звичайних температурах пояснюється утворенням на його поверхні захисної оксидної плівки типу рутилу (ТiO2). Рутил досить стійкий по відношенню до кислот і лугів. В окисних середовищах титан стійкий у присутності хлорид-іонов. За стійкістю в розчинах нітратної і хромової кислот титан перевершує всі метали. Так, в азотній кислоті він стійкий аж до температури кипіння. При звичайних температурах на титан не діє «царська горілка». В органічних кислотах (молочна, оцтова, стеаринова і ін.) відполірована поверхня титану навіть не втрачає свого блиску.
Метал стійкий у вологому хлорі(у сухому - нестійкий), в парах сірки і її сполук. У слабких розчинах плавикової, мурашиної, щавлевої і концентрованих хлоридної і сульфатної кислот захисний шар не утворюється і відбувається інтенсивна корозія титану.
В розплавах солей і металів корозійна стійкість титану неоднакова: так, в розплаві хлориду натрію при контакті з повітрям титан сильно кородує, а в атмосфері інертних газів корозія незначна. Титан стійкий, в розплавленому вісмуті, олові, свинціпри 300°С, калію, натрію - при 600°С, розплавленій сірці - при 240°С, а в розплавах цинку інтенсивно кородує. В окремих випадках, наприклад в 15 %-му розчині сульфатної кислоти, в димлячій нітратній кислоті, титан схильний до міжкристалітній корозії.
З органічних середовищ, в яких титан стійкий, можна назвати: бензин, толуол, фенол, трихлоретан, формальдегід. У тетрахлориді вуглецю титан не кородує навіть за наявності іонізуючого випромінювання.
В атмосферних умовах швидкість корозії титану не перевищує 1-10-4 мм/рік. В морській воді титан практично не піддається корозії. Розрахована швидкість корозії титану в морській воді складає всього 2- 10-5 мм/рік.
Сплави титану з молібденом (3-5%) достатньо стійкі в розчинах хлоридної, сульфатної і фосфорної кислот. Високі корозійні і механічні властивості мають сплави, що містять 32—34 % Мо. Але вони нестійкі в концентрованих розчинах сульфатної і нітратної кислот.
Сплави титану, що містять більше 40 % танталу, володіють корозійною стійкістю в таких сильно агресивних середовищах, як киплячі розчини 20 %-ної хлоридної і 30 %-ної сульфатної кислот.
Розроблені корозійностійкі титанові сплави типу Тi — Мо — Nb — Zr.
При корозії з водневою деполяризацією титанові сплави насищаються воднем, при цьому значно знижуються їх механічні властивості.
Одночасна дія розтягуючої напруги і хлоридів при підвищених температурах приводить до корозійного розтріскування титанових сплавів. При збільшенні частки алюмінію в сплавах знижується опір корозійному розтріскуванню.
Анодна пасивація дозволяє використовувати титан як матеріал для підвісок у ваннах анодування алюмінію.
4. КОНСЕРВАЦІЯ МЕТАЛОВИРОБІВ
Під консервацією розуміють спеціальний захист металовиробів від корозії в періоди їх зберігання або транспортування. Це тимчасові заходи захисту від корозії, оскільки засоби захисту (консерванти) легко і просто видалити з поверхні металу в той момент, коли виріб необхідно перевести в робочий стан.
Виділяють чотири групи засобів консервації: масла і мастила; інгібітори корозії; осушувачі корозії; інертні атмосфери. Часто для консервації використовують робочі масла з добавками присадок-інгібіторів (АКОР-1 або КП) в кількості 5-15% від маси суміші консервації.
Інгібітори корозії для консервантів повинні добре розчинятися у вуглеводневих середовищах, адсорбуватися на поверхні металу, досягаючи гідрофобного ефекту . Концентрацію інгібітору в маслах консервації і мастилах визначають агресивністю і температурою середовища (атмосфери), видом покриття і властивостями металу, що захищається.
ХІМІЧНИЙ ОПІР МАТЕРІАЛІВ
Содержание
Дата добавления: 2015-11-06; просмотров: 1349;
