Кавитационная эрозия 4 страница
Для захисту від корозії, розмірного відновлення зношених деталей машин використовують практично всі метали, металокераміку, карбіди, пластмаси, скло, які можна наносити не тільки на метал, але і на дерево, бетон, скло, кераміку, папір.
При металізації покриття утворюється за рахунок вклинення розплавлених частинок металу або іншого матеріалу в пори і прилипання до нерівностей поверхні деталі. Міцність зчеплення залежить від розміру частинок, швидкості їх руху і ступеня деформації при ударі об поверхню. Покриття має лускату структуру і високу пористість, яку зменшує шляхом збільшення товщина покриття, шліфуванням, поліруванням і нанесенням неметалічних покриттів. Наприклад, пористість цинкового покриття зменшується в 10 разів при збільшенні його товщини від 0,2 до 0,4 мм.
Металізацію розпилюванням застосовують для захисту від корозії ємкостей і апаратури крупних габаритів: казанів вулканізації, залізничних мостів, газгольдерів, морських труб, металоконструкцій шлюзів дамб, зібраних виробів і ін. Для захисту від атмосферної і підземної корозії застосовують цинк і алюміній, що наносяться на сталь і чавун завтовшки від 0,05 до 4 мм. Апаратура сірчанокислотного виробництва покривається свинцем, а від дії водяної пари, сірчистого газу, морської атмосфери (при підвищених температурах) - алюмінієм товщиною до 0,3 мм.
Взаємозв'язок покриття – основаМетали можна класифікувати і так: що окислюються або "жертвенниє", благородні або "нежертвенниє", інертні. Перша і друга категорії відносяться до металевих покриттів, а третя - тільки до неметалічних захисних покриттів, тому ми її відкинемо. Хоча з термодинамічних позицій в ідеальних умовах потенційні можливості такого взаємозв'язку можуть показатися достатньо ясними, на практиці виникають різні можливості і перед конструкторами, чиї глибинні знання тонкощів науки про корозію мінімальні, можуть вставати серйозні проблеми. Положення може бути пояснене коротко і просто: покриття буде, що окислюється, захищати основу як жертвенноє, даючи хороший електролітичний контакт в місцях гострих кромок, дефектних областей або пір; благородне покриття не може давати хорошого жертовного захисту основи, даючи при її оголенні в місцях порушення сплошності покриття ідеальні ситуації для локальної корозії. Невпевненість виникає не тільки для таких пар металів як кадмієве покриття на сталі (де термодинамічні потенціали дуже близькі, і, відповідно, різниця в їх поляризації настільки мала, що в корозійній парі полярність може змінюватися), але і для таких металів як цинк або алюміній, використовуваних як жертовні покриття. Вони можуть приймати значно більший потенціал, перестававши внаслідок цього бути жертвеннимі. В основному, існують дві причини вказаної зміни полярності: метал, що окислюється, може пасивуватися, зміщуючи свій потенціал у бік більшого "благородства"; благородний метал може розчинятися у вигляді складних іонів, знижуючи таким чином потенціал окислювального розчинення металу.
Незначні зміни в середовищі, зазвичай в присутності або відсутності хлоридів, сульфатів, нітратів і так далі можуть значно змінити відносний потенціал пари: більш ніж на 1 В [2].
Хоча зазвичай практичні навики отримуються з досвідом, корисним кроком 'перед з'явилася публікація проекту [3], який може бути названий таблицями біметалічних пар корозії. Хоча таке наближення і може мати очевидні обмеження, важливість зробленого кроку вперед для конструкторів тим самим не зменшується, ці матеріали вивчатимуться всіма.
Пористість покриттів
Хоча швидкість загальної корозії і служить корисною порівняльною характеристикою, але саме локальна корозія унаслідок дуже високої швидкості, виникаючи на тріщинах і в кавернах, є причиною катастрофічно швидких поломок. Пори є класичним прикладом заздалегідь сформованих локальних дефектів: поверхневих включень в основу; залишкових лусочок або забруднень, абразивних включень
|
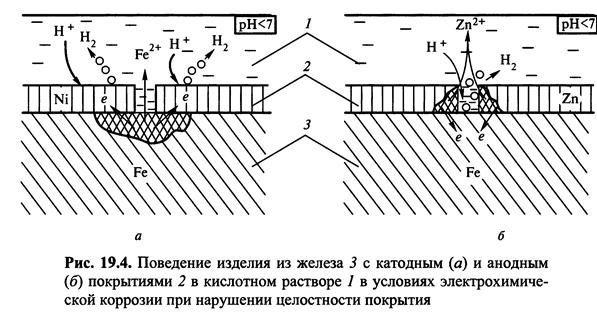
Рже. 2. Залежність пористості (/>) покриття - гальванічного хрому від його товщини d
поверхневих тріщин, каверн, подряпин і так далі Пористість пов'язана з недосконалістю попередніх процесів, таких як очищення, труїть, обкатка, механічна обробка. У міру зростання товщини покриття майже завжди пористість падає експоненціально (мал. 2), що було показане на багатьох металевих покриттях.
Мінімальна товщина, при якій можливе отримання низької пористості (* 5 %), складає зазвичай 1 мкм, хоча ясно, що цей критерій сильно залежить від обставин. Так, для жертовного покриття цинку на сталі деяка пористість не є серйозною перешкодою, оскільки в більшості середовищ цинк забезпечує катодний захист стали за допомогою зв'язаних пір. Проте для благородного покриття така пористість може виявитися катастрофічною, особливо для такого металу як золото, де по економічних міркуваннях для декоративних цілей товщина не повинна перевищувати 2 мкм. На щастя, часто катастрофа може запобігти шляхом використання 5-10-мкм підшару нікелю, який і створює реальний бар'єр для захисту стали або мідь, а також ціаністою гальваніки, яка забезпечує чистоту з погляду включень, а також володіє хорошою здібністю до утворення суцільних покриттів. Для декоративного хрому, де нормальна товщина може складати 0,1-1,5 мкм, реальний тривалий захист забезпечується, в основному, підшарами з нікелю і/або міді (загальною товщиною в 5-50 мкм); загальноприйнятою практикою є створення мікронеоднородностей - або пір, або тріщин в шарі хрому для ефективного розсіяння зон, що вражаються, і, тим самим, зведення до мінімуму катастрофічних змін.
В області пористості покриттів, зокрема, необхідні хороші об'єктивно якісні випробування, які могли б бути корисні в лабораторіях рутинного контролю якості і які також могли б використовуватися для вивчення причин утворення пористості, - як наслідок поганої якості попередньої обробки в промисловому виробництві.
Покриття із сплавів металів
В минулому часто розглядалася важливість заміни сплавів на метали в покриттях, оскільки сплави непросто застосовувати, використовуючи безпосередньо традиційні технології нанесення. Одного разу, коли розглядалися нові шляхи, гідні дослідження, було визнано, що сплави можуть мати деякі переваги у властивості, а вплив методів їх нанесення не завжди негативно як при формуванні крихких, але захисних дифузійних шарів. Покриття можна отримати безпосередньо гальванічним осадженням сплавів напиленням або гарячим зануренням, а також сформувати при загальній або подальшій термообробці. Якщо термін "сплави" використовувати в його найбільш широкому трактуванні, то до неорганічних сплавів можуть бути зараховані покриття із сплавів металів і неметалів таких як фосфати ранжирувані від м'якої (1) до дуже жорсткою (4). Детальний розгляд категорій по відношенню до корозійних випробувань був виконаний Картером [5] і має важливе значення для створення стандартної класифікації систем покриттів. Великий діапазон термінів служби - від шести тижнів для пивних банок до 100 років для моста, робить нереальним створення таких детальних рекомендацій.
ТОНКОШАРІ ПОКРИТТЯ Фосфатні і оксидні захисні плівки
Більшість металів в атмосферних умовах покриті оксидними плівками. Проте ці плівки не завжди забезпечують захист від корозії. Методами хімічної і електрохімічної обробки можна створити на поверхні фосфатні або оксидніпокриття, які володіють високою адсорбційною здатністю, електроізоляційними властивостями, підвищеною твердістю і зносостійкістю. При додатковій обробці пасивуючими розчинами, змащувальними або лакофарбними матеріалами значно підвищується корозійна стійкість металів і сплавів. ФосфатуванняТехнологія процесу фосфатування проста. Фосфатування застосо-вують для чорних і кольорових металів і воно полягає в утворенні малорозчинних фосфатів заліза, марганцю або цинку. Заснований метод на властивостях солей фос-фатної кислоти. Фосфатна кислота — Н3РО4 — може утворювати три види солей:
• однозаміщені - дігидрофосфати Ме(Н2РО4)2;
• двохзаміщені - моногидрофосфати МеНРО4;
• тризаміщені - фосфати Ме3(РО4) (де Ме — двувалентний метал).
У воді розчиняються тільки фосфати амонія і лужних металів. Дво- і тризаміщені фосфати заліза, марганцю і цинку малорозчинні. Отже, якщо створити умови для їх утворення, то вони залишатимуться на поверхні металу.
При взаємодії металу з фосфорною кислотою спочатку утворюються дігидрофосфати:
Ме + 2Н3РО4 = Ме(Н2РО)2 + Н2
При зниженні концентрації фосфатної кислоти отримують вторинні і третинні солі:
Ме(Н2РО4)2 = МеНРО4 + Н3РО4
ЗМе(Н2РО4)2 = Ме3(РО4)2 + 4Н3РО4
В утворенні фосфатної плівки беруть участь продукти взаємодії фосфорної кислоти з металом і речовини, що входять до складу розчину для фосфатування.
Передбачається, що утворенню фосфатної плівки передують реакції іонізації заліза:
Fе = Fе2+ - 2е і виділення гідрогену:
2Н+ + 2е = Н2
Ді- і трифосфати, що випадають в розчин, кристалізуються на поверхні сталевого виробу, утворюючи щільну кристалічну плівку.
Фосфатування закінчується після того, коли вся поверхня покриється суцільною плівкою і виділення водню припиниться.
Фосфатні плівки володіють хорошою адгезією, має високорозвинуту шорстку поверхню. Вони є хорошим грунтом для нанесення лакофарбних покриттів і просочуючих мастил. Фосфатування використовують для виробів, які експлуатують в морській воді, в тропічних районах. Недоліком фосфатних плівок є низька міцність і еластичність. Вони мають короткий термін експлуатації.
Оксидування
Оксидування - це процес утворення оксидних плівок на поверхні металевих виробів.
Сучасний метод оксидування - хімічна і електрохімічна обробка деталей в лужних розчинах.
Електрохімічне оксидування ведуть в розчині
- 4 %-го їдкого натра при 65-120 °С і анодній щільності струму від 2,5 до 10 А/дм2. Тривалість анодної обробки не перевищує 60 хвилин.
Якісне покриття складається з магнітного оксиду заліза, що виходить в результаті послідовних перетворень:
Fе -> Nа2 FеО2 -+ Nа2Fе2О4 -> Fе3О4
Оксидування чорних металів носить також назву вороніння.
Його здійснюють в розчині складу (г/л): КаОН — 600-700; КаШ2 — 200-250; ЫаШ3 — 50-100. Температура — 135-145 °С, время 30-90 мин.
У процесі відбувається розчинення заліза з утворенням сполук Nа2FеО2 и Nа2Fе2О4, з яких утворюється поверхнева плівка оксиду заліза — FезО4:
Nа2FеО2 + Nа2Fе2О4 + 2Н2О = Fе3О4 + 4NаОН
Оксидна плівка на маловуглецевій сталі має глибокий чорний колір, а на високовуглецевих сталях - чорний з сіруватим відтінком. Для підвищення антикорозійних властивостей оксидований виріб занурюють на 2-3 мін в гарячий 2-3 %-й розчин мила, а потім на 5-10 мін в мінеральне трансформаторне або машинне масло при температурі 105-120 °С. Після цієї операції поверхня покриття стає блискучою, з рівномірним чорним забарвленням. Можливе оксидування і магнієвих сплавів - в хромокислих електролітах з подальшим нанесенням лакофарбних покриттів. Товщина оксидних плівок складає 0,8-1,5 мкм.
Протикорозійні властивості поверхневої плівки оксидів невисокі, тому область застосування цього методу обмежена. Основне призначення його - декоративна обробка. Майже вся стрілецька зброя і ряд точних приладів піддають воронінню, внаслідок чого вироби набувають красивого чорного кольору. Вороніння використовують і у тому випадку, коли необхідно зберегти початкові розміри виробу, оскільки оксидна плівка складає всього 1,0-1,5 мікрона.
Пасивування
Для захисту від корозії застосовують метод пасивування - обробка металу в розчинах хроматів або нітратів.
Для пасивування оцинкованих виробів застосовують розчин: 8-10мл/л Н2ЗО4 и Ка2Сг2О7-2Н2О — 200г/л. Час обробки 5-30с. Від часу обробки залежить забарвлення плівки. При витримці 5 с. колір плівки веселковий із зеленуватим відтінком, а маса плівки складає 0,9-1,2г/м2. При подальшому збільшенні часу колір міняється від жовтого до коричневого.
Для пасивування алюмінію використовують розчин біхромату калія (200 г/л) і 2 мл/л НР.
Пасивація міді в хроматних розчинах дає особливо хороші результати при захисті виробів, дотичних з парами SО2 и растворами нейтральных солей. Сталеві деталі можна обробляти в 60-90 %-м розчині нітриту натрію. В результаті вони не іржавіють протягом двох років. |
Анодування
Анодування - це процес утворення оксидних плівок на поверхні алюмінію. У звичайних умовах на поверхні алюмінію присутня тонка плівка оксидів А12Оз или А12Оз х пН2О, яка не може захистити його від корозії. Під впливом навколишнього середовища алюміній покривається шаром рихлих білих продуктів корозії. Процес штучного утворення товстих оксидних плівок може бути проведений хімічним і електрохімічним способами.
Плівки, що утворюються при анодній обробці алюмінію, володіють достатньою товщиною і поряд цінних властивостей. Вони захищають метал від корозії і є хорошим підшаром під лакофарбні покриття. Анодні плівки на алюмінії володіють великим опором до стирання, мають високий омічний опір і добре забарвлюються, що дозволяє додати виробам з анодованого алюмінію красивий вигляд. Для анодного окислення використовують два типи електролітів.
У розчинах слабких кислот (борова, винна, лимонна) і їх солей оксидна плівка не розчиняється. В цьому випадку отримують безпористі, щільні, не провідні електричний струм покриття товщиною до 1 мкм. Такі плівки використовують як електроізоляційні покриття у виробництві конденсаторів.
Електроліти другого типу містять розчини сарною, хромової і щавлевої кислот, в яких відбувається часткове розчинення оксидної плівки алюмінію. У цих електролітах отримують пористі плівки завтовшки від 1 до 50 мкм.
На практиці анодування алюмінію і його сплавів проводять в розчинах сірчаної кислоти концентрацією 180-200 г/л, хромового ангідриду (3 %-го) і щавлевої кислоти (3-10 %-й) з щільністю струму 80-200 А/м2, при напрузі до 24в протягом 15-60 мин. Катоди виконуються зі свинцю або сталі мазкі 12х18н9т.
Для підвищення захисних властивостей виріб після оксидування обробляють парою або гарячою водою і далі в гарячих розчинах хроматів і біхроматів. При обробці парою в порах плівки утворюється гідроксид алюмінію, а в хромових розчинах - стійкіші сполуки типу (А1О)2СЮ4.
Оксид утворюється на поверхні алюмінію в результаті анодного окислення:
2А1 + ЗН20 - А1203 + 6Н+ + бе Він складається з двох шарів: щільного бар'єрного шару завтовшки
0,01-0,1 мкм, розташованого безпосередньо на поверхні металу, і зовнішнього пористого шару завтовшки до 200-400 мкм.
Хімічне оксидування алюмінію і його сплавів здійснюють в лужних хромистих розчинах складу (г/л):
Nа2СrO4 — 15; NаОН — 2,5 и Nа2СО3 — 50 при температурі 90-95 °С протягом 5-10 мин. Утворюються плівки товщиною 3-4 мкм з невисокими механічними і діелектричними властивостями. Процес простій, швидкий і не вимагає спеціального устаткування.
9.2. Гальванічні покриття
Одним із способів захисту від корозії є нанесення поверхневих гальванічних покриттів. Електроосадження має ряд переваг перед іншими методами захисту, оскільки воно дозволяє:
- регулювати товщину шару;
- економно витрачати кольорові метали;
- наносити покриття з металів, що мають високу темпера
туру плавлення, як те хром, нікель, мідь, срібло, платина.
Захисні електрохімічні покриття повинні володіти:
- здатністю ізолювати виріб від агресивного середовища;
- власною корозійною стійкістю;
- заданими фізико-механічними властивостями.
Всі ці якості визначаються умовами зародження і зростання кристалів.
Отримання осадів з високими захисними властивостями можливо при введенні в електроліт різних добавок і поверхнево-активних речовин, які часто мають жорсткі екологічні нормативи. Тому вдосконалення процесів електрохімічних покриттів вже не може базуватися на пошуках органічних добавок, а вимагає детального физико-хімічного вивчення закономірностей зростання кристалів. Останнім часом з'явилося багато науково-дослідних і оглядових робіт в цьому напрямі.
Було показано, що утворення моношару адсорбованих атомів слід розглядати як першу стадію електроосадження металів. Вона грає важливу роль у визначенні характеру подальшого зростання і властивостей покриттів.
Численні дослідження показали, що для більшості систем моношари складаються з нейтральних атомів, мають однорідний розподіл, і їх адсорбція може бути описана ізотермами Фрумкина і Темкина.
Аніони С1, Вг ^, 8о^ впливають на утворення моношарів, конкуруючи з адсорбованими атомами і роблячи вплив на властивості поверхні.
Моношари металів відрізняються за своїми фізичними властивостями від масивного металу. Так, адсорбція срібла на платині знижує роботу виходу електронів з 5,8 до 2,7 ев. При товщині більше трьох моношарів робота виходу стає рівною чистому металу.
Активні центри грають важливу роль в процесах електрокристалізації, визначаючи число виникаючих кристалів.
Введення ряду поверхнево-активних речовин (ЛІГШИ) впливає на число активних центрів і процеси зародження кристалів. Електроосадження металів відбувається, як правило, при високих перенапруженнях. Електроосаджені шари у присутності ПАВ мають розмір кристалів на декілька порядків менше, ніж при звичайній кристалізації, оскільки адсорбція домішок гальмує лінійне зростання кристалів, а високе перенапруження сприяє виникненню великого числа кристалів. В цьому випадку осідання виходять тверді, малопластичні, а іноді і крихкі.
Адсорбція домішок викликає порушення в побудові кристалічної решітки, яка містить точкові (вакансії і домішки), лінійні (краєві і гвинтові дислокації) і площинні дефекти. Висока концентрація вакансій обуславліваєт різке підвищення швидкості дифузійних процесів, кількість дефектів в кристалічній решітці збільшується. Дефекти кристалічної решітки роблять істотний вплив на фізичні властивості опадів, що утворюються. В деяких випадках на електроді виникає жідкоподобная структура - металеві стекла. Не маючи меж зерен, вони є однорідними метастабільними системами і часто володіють вищою корозійною стійкістю в порівнянні з кристалічними осіданнями такого ж хімічного складу.
Вид покриття, його товщина і призначення регулюються ГОСТ 9.303-84, і ГОСТ 9.306-85.
Захисні антикорозійні покриття можуть бути анодними і катодними.
Металеві покриття повинні бути непроникними для корозійних агентів. Проте, якщо в металевому покритті є дефекти у вигляді пір, подряпин, вм'ятин, то характер корозійного руйнування основного металу визначається електрохімічними характеристиками обох металів. По відношенню до сталі цинкове покриття є анодним, а мідне покриття - катодним. Тому спочатку починає руйнуватися цинк.
КОРОЗІЯ СПЛАВІВ НА ОСНОВІ ЗАЛІЗА
1. КОРОЗІЯ ВУГЛЕЦЕВИХ СТАЛЕЙ
Залізо і сплави на його основі не володіють корозійною стійкістю в агресивних середовищах. Проте залізо і його сплави легко пасивуються, їх досить легко і просто захистити від корозії самими різними методами, вартість їх невисока, тому вони є найважливішими конструкційними матеріалами.
Стандартний електродний потенціал заліза дорівнює E(Fe2+/ Fe ) = - 0,44 В і E(Fe3+/ Fe ) = - 0,037 В. У водопровідній воді у присутності розчиненого оксигену повітря стаціонарний потенціал заліза рівний —0,40 В, а в 3%-му розчині хлориду натрію до
-0,50 В. Тому залізо може кородувати і з кисневою, і з водневою поляризацією. У розчин залізо переходить з продуктами корозії у вигляді катіонів Fe (II), які потім окиснюються до катіонів Fe (Ш). На поверхні металу йдуть процеси:
Fe +1/2О2 + Н2О + 2СО2= Fe (НСО3)2
Fe (НСО3)2 + 2Н2О= Fe (ОН)2 + 2Н2СО3
2 Fe (ОН) 2 + Н2О + 1/2О2=2 Fe (ОН)3
Оксидна плівка на поверхні металу (іржа) складається з суміші гідроксидів заліза (II) і (III), має змінний склад: nFeО•mFeО3•рН2О і не відповідає вимогам, щодо захисних оксидних плівок.
Всі залізовуглецеві сплави неоднорідні за хімічним складом і за своїми структурними складовими. До того ж структурні складові сплавів системи Fe — Fe3С відрізняються за значенням електродних потенціалів, тому корозійні мікроелементи, що утворюються при контакті цих сплавів з розчинами електролітів, працюють дуже інтенсивно. Можлива різниця потенціалів із-за неоднорідності структури може мати значення 0,8-0,9 В, оскільки електродний потенціал заліза - 0,44 В, а графіту +0,37 В. Хімічна неоднорідність сплавів (наявність різних добавок і домішок) теж значно впливає на швидкість процесу корозії, особливо для корозії з водневою деполяризацією. Сплави заліза, що містять мінімальну кількість домішок (наприклад, залізо армко - 0,02 % С), досить стійкі в деяких агресивних середовищах.
При звичайних температурах корозія заліза в нейтральних середовищах відбувається тільки за наявності розчиненого оксигену. Інтенсифікація процесу корозії спостерігається в тих випадках, коли оксиген грає роль деполяризатора і корозія лімітується швидкістю дифузії оксигену, отже, швидкість корозії заліза також пропорційна концентрації оксигену.
При значній концентрації оксигену у воді (12-15 мг/л) може виявитися його позитивна дія внаслідок пасивації заліза оксигеном.
Швидкість корозії заліза в слабокислих, нейтральних і слаболужних середовищах не залежить від зміни рН і визначається швидкістю дифузії оксигену до поверхні металу. Швидкість корозії в області рН = 4-10 залежить від природи солей, що знаходяться в розчині, їх концентрації, наявності окисників, температури розчину і інших чинників.
При рН<4 плівка оксиду заліза(II) швидко розчиняється і метал вступає в безпосередній контакт з навколишнім середовищем. В цьому випадку швидкість корозії зростає із зменшенням рН. На швидкість процесу корозії при цьому впливають також природа аніона кислоти, температура, характер домішок і продуктів корозії, що утворюються.
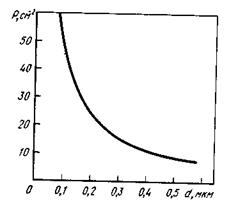
В кислотах, що не володіють окисними властивостями по відношенню до заліза, залізо і залізовуглецеві сплави руйнуються, оскільки продукти корозії , що утворюються, розчинні в даному середовищі. До таких агресивних середовищ можна віднести розбавлені розчини сульфатної до 76 %, нітратної до 30 % (мал. 65),
|
фтористоводневої до 50 % і хлоридної кислоти. В розчинах хлоридної кислоти при збільшенні концентрації відбувається різке (експоненціальне) зростання швидкості корозії. Підвищення температури розчину також сприяє інтенсифікації руйнівного процесу. Розчини, що містять менш 30% НNO3, викликають значну корозію заліза і залізовуглецевих сплавів. Подальше збільшення концентрації НNO3 приводить до уповільнення швидкості корозії внаслідок їх пасивації. При концентрації НNO3 від 94 до 98 % залізовуглецеві сплави інтенсивно руйнуються, що пов'язане з перепасивацією.
Якщо кислота є окисником, то з підвищенням концентрації посилюються її пасивуючі властивості, тому в концентрованих розчинах таких кислот стійкі як залізо, так чавуни і сталі.
Підвищена корозійна стійкість заліза і сплавів системи Fе — Fе3С у розчинах сульфатної кислоти з концентрацією 76,0- 90,0 % пояснюється утворенням на поверхні металу захисного шару з сульфату заліза, який не розчиняється в сульфатній кислоті. В олеумі при вмісті вільного SО3 вище 25 % залізовуглецеві сплави не піддаються корозії, проте застосування чавуну в цьому випадку не рекомендується, оскільки під дією олеуму може протікати міжкристалітна корозія чавуну.
В розчинах органічних кислот (оцетової, мурашиної, щавлевої і ін.) залізо і залізовуглецеві сплави схильні до сильної корозії, яка посилюється при доступі оксигену і з підвищенням температури і швидкості руху середовища.
У лужному середовищі швидкість корозії знижується, оскільки залізо у присутності лугів і розчиненого оксигену починає все більш пасивуватися.
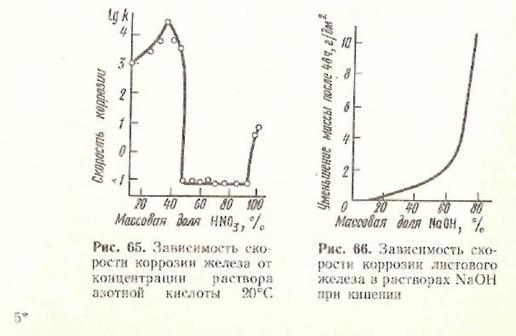
Залізо, сталь, чавун стійкі в розчинах лугів з концентрацією до 30 % (мал. 66), в цьому випадку на поверхні металу утворюються нерозчинні продукти корозії (гідроксиди заліза (II) і (III)), що володіють хорошим зчепленням з поверхнею і що оберігають її від подальшої корозії. З підвищенням концентрації лугів стійкість сплавів зменшується.
Підвищення температури приводить до руйнування захисних плівок.
Корозійне розтріскування вуглецевих сталей - «лужна крихкість» - спостерігається в умовах експлуатації парових казанів при концентраціях лугу у воді більше 15 %, температурі розчину вище 65°С і за наявності значної механічної напруги.
В нейтральних, слаболужних і слабокислих розчинах солей корозійна стійкість заліза і залізовуглецевих сплавів залежить від концентрації і електричної провідності розчину, ступеня його аерованості і від природи аніонів і катіонів середовища
Одним з основних чинників, що визначають швидкість корозії для таких розчинів, є розчинність продуктів корозії ; рН середовища, як правило, не впливає на швидкість корозії в розчинах солей.
При збільшенні концентрації розчину солі швидкість корозії сплаву зростає. Уповільнення корозії при подальшому збільшенні концентрації солі в розчині пов'язане із зменшенням розчинності оксигену зі зростанням концентрації розчинів.
Солі лужних і лужно-земельних металів збільшують електричну провідність розчину, яка підсилює роботу мікроелементів, що приводить до зростання швидкості корозії.
Розчини нітратів менш агресивні, чим хлоридів, а розчини нітриту при певних концентраціях , можуть діяти як інгібітори («сповільнювачі корозії»).
Вплив природи катіонів і аніонів на швидкість корозії позначається в процесі утворення плівок з продуктів корозії на поверхні металу. Розчини хлоридів, сульфатів, нітратів лужних металів при взаємодії із залізом утворюють розчинні продукти. У розчинах карбонатів і фосфатів натрію і калію на анодних ділянках заліза утворюються нерозчинні плівки карбонату і фосфату заліза, це знижує швидкість корозії із-за пористості плівок залізовуглецеві сплави руйнуються.
Розчини солей, що володіють окисними властивостями (хромати, дихромати, манганати), не руйнують залізо і залізовуглецеві сплави. В розчинах солей руйнування протікає за схемою
Fе + Сu2+ = Fе2++Сu
В органічних середовищах (етанол, метанол, бензол) залізо і залізовуглецеві сплави не кородують. Але наявність слідів вологи веде до швидкого руйнування металу.
Помітний вплив на швидкість корозії залізовуглецевих сплавів в кислих середовищах, що не містять окисників, надає вміст вуглецю в сплаві (мал. 67). При корозії у воді вміст вуглецю в сплаві не має ніякого значення, але в морській воді підвищення змісту вуглецю викликає деяке збільшення швидкості корозії.
КОРОЗІЙНА СТІЙКІСТЬ ЛЕГОВАНИХ СТАЛЕЙ
Єдиного підходу до створення сплавів не існує. Не створено сплаву стійкого проти корозії в будь-яких середовищах. Так, легування сталі хромом - надійний метод захисту від корозії при роботі в пасивному стані, але абсолютно марно при роботі в неокисних середовищах (НС1, Н2SО4 роз.), де корозія протікає з катодним контролем.
При створенні нових корозійних сплавів необхідно враховувати таке правило: «Склад сплаву потрібно міняти так, щоб в передбачуваних умовах експлуатації досягалося підвищення основного контролюючого чинника корозії». В умовах, коли можлива пасивація основи сплаву, найбільший ефект може бути отриманий від легуючих компонентів, що підвищують здатність основи до пасивації, або ефективність катодного процесу.
Залежно від основних властивостей леговані сталі розділяють на три групи: неіржавіючі (корозійностійкі); жаростійкі (окалиностійкі) і жароміцні.
Дата добавления: 2015-11-06; просмотров: 1095;
