Склад газового середовища 2 страница
Корозію, що супроводиться відновленням (іонізацією) молекул кисню, називають корозією з поглинанням кисню, або корозією з кисневою деполя-ризацією. Корозію, що супроводиться відновленням молекул води і іонів водню, називають корозією з виділенням водню, або корозією з водневою деполяризацією. В деяких умовах електрохімічна корозія може протікати одночасно і з водневою, і з кисневою деполяризацією – так званий змішаний вид деполяризації.
Процеси, що протікають на поверхні електродів, називаються первин-ними процесами . Вторинні процеси – хімічні взаємодії первинних продуктів один з одним, з компонентами електролітного корозійного середовища, з роз-чиненими в ній газами і ін. При цьому утворюються плівки малорозчинних вторинних продуктів корозії, наприклад, гідроксидів, фосфатів металів:
Меn+ + ОН- = Ме(ОН)n ↓
3Меn+ + n (PО4)3- = Ме3(PО4)n ↓
які утрудняють доступ електроліту до поверхні металу. В результаті знижується швидкість електрохімічної корозії, а інколи корозія і зовсім припиняється. Процес корозії здійснюється постійно ліше в тому випадку, якщо електрони з катодних ділянок відводяться акцепторами електронів – деполяризатора-ми. Таким чином, електрохімічна корозія на неоднорідній (гетерогенній) по-верхні металу аналогічна роботі гальванічного елементу:
Мал. Механізм корозії системи Fe/ Cu в електроліті.
А- (анод) - залізний
Е0 (Fe/Fe2+) = - 0.44 B
( стандартний потенціал)
 1) Fe0 -2e- = Fe2+ 1) Fe0 -2e- = Fe2+

| Розчин електроліту (HCl, NaOH, O2 + H2O) + 2OH- = Fe(OH)2 ↓ + 2Cl- = FeCl2 3) Кисле середовище: 2H+ + 2e- =H2 (воднева деполяризація) Нейтральне середовище: O2 + 2H2O + 4e- = 4OH- ( киснева деполяризація) |
 К+(катод) – гідрогенний
(або оксигенний)
Е0 (Cu)2H+/H2 = 0 B 2) n e- e-
e-
e-
e- К+(катод) – гідрогенний
(або оксигенний)
Е0 (Cu)2H+/H2 = 0 B 2) n e- e-
e-
e-
e-
|

 ТВЕРДА ФАЗА РІДКА ФАЗА
ТВЕРДА ФАЗА РІДКА ФАЗА
ГЕТЕРОГЕННА СИСТЕМА
Чим вище концентрація деполяризатора, тим інтенсивніше асиміляція електронів, більше корозійний струм, який протікає між катодом і анодом, і швидше проходить корозія.
2.4 Термодинаміка електрохімічної корозії
Можливість електрохімічної корозії, як і будь-якого хімічного процесу, визначають по зміні енергії Гіббса. Оскільки корозія є самовільним процесом, то супроводиться її спадом, тобто ∆GТ < 0. Негативному значенню ∆GТ відповідає позитивне значення ЕРС, яку розраховують по різниці значень електродних потенціалів катода і анода (або окисника і відновника):
∆Е = Ек – Еа = ЕOx – EМе > 0
Звідси витікає, що електрохімічна корозія можлива, якщо потенціал окисника (деполяризатора) більше потенціалу відновника (металу): ЕOx > EМе..
Зміна енергії Гіббса ∆G зв’язана з ЕРС елементу співвідношенням
∆G0 = - nF∆E,
де n — число електронів, що беруть участь в реакції; F— постійна Фарадея (96500 Кл/моль).
Потенціали катодних реакцій (кисневого і водневого електродів) залежать від кислотності (водневого показника) розчину і парціального тиску газів. Стандартний електродний потенціал водню Е0 = 0 В, тоді
E2Н+/Н2 = 0,059 lg аН+ - 0,0295 lg рН2 =- 0,059рН - 0,0295 lg рН2
аН+ - активність іонів водню в розчині; рН2- тиск газоподібного водню над розчином; рН=- lg аН+ - водневий показник розчину.
При рН2= 1 :
E2Н+/Н2 = - 0,059 рН .
При зміні рН на одиницю потенціал водневого електроду зменшується на 59мВ. Оскільки рН середовища може істотно розрізнятися (от 0 до 14), по-тенціал водневого електроду змінюється від +0,186 до —0,828 В.
Рівняння Нернсту для кисневого електроду при Т=298 К має вигляд: EО2/ОН- = 1,23 - 0,059 рН + 0,015 lg рО2
або при рО2 = 1 EО2/ОН- = 1,23 - 0,059 рН Потенціал кисневого електроду позитивніше водневого електроду на 1,23 В.
Киснева деполяризація характерна для найбільш поширеної природної корозії (на повітрі, в грунті, воді), а потенціал кисневого електроду ва-ріює в межах від +1,23 до +0,401 В.
2.5. Діаграми Пурбе
Для характеристики термодинамічної стійкості електрохімічних систем у водних розчинах можна використовувати діаграму залежності потенціала від рН (діаграму електрохімічної стійкості води). На діаграмі (мал. 3 ) приведені лі-нії рівноважного потенціалу водневого (лінія б) і кисневого (лінія а) електродів.
|
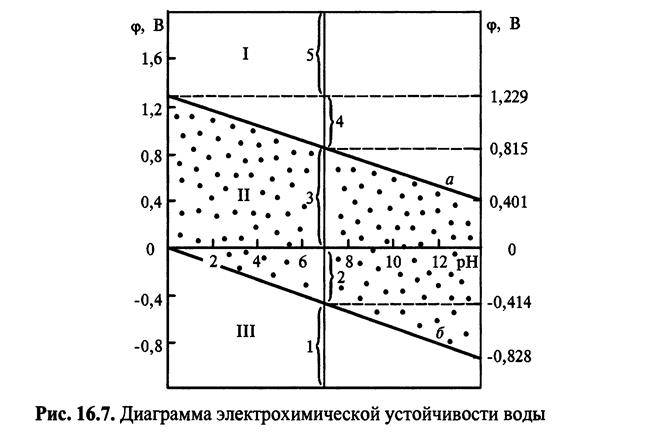 У водних середовищах, що містять H+ і О2, метали кородують по-різному залежно від рН:
У водних середовищах, що містять H+ і О2, метали кородують по-різному залежно від рН:
а) якщо ЕМе/Меn+ > ЕО2/ОН- (область I), то корозія металу практично неможлива (наприклад, Au);
б) якщо ЕО2/ОН- > ЕМе/Меn+ > ЕН+/Н2 (область II), то корозія можлива з поглинанням О2 і неможлива з виділенням Н2 (наприклад, Cu, Ni, Cd, Sn);
в) якщо ЕМе/Меn+ < ЕН+/Н2 (область III), то корозія можлива як з поглинанням О2, так і з виділенням Н2 (наприклад, Zn, Al, лужні і лужноземельні метали).
За значенням ЕМе всі метали підрозділяють на 5 груп:
1. Метали низької термодинамічної стабільності (ЕМе/Меn+ < -0,414 В) кородують навіть в нейтральних середовищах, що не містять кисень і окисники: Na, Mg, Ве, Al, Znі ін.
2. Метали термодинамічно нестабільні ( -0,414 < ЕМе/Меn+ < 0 В) стійкі в нейтральних середовищах за відсутності кисню, але в кислотних кородують навіть при його відсутності: Cd, Ni, Sn, Pb і ін.
3. Метали проміжної термодинамічної стабільності (0 < ЕМе/Меn+ < 0,814 В) стійкі в нейтральних і кислотних середовищах за відсутності кисню і окисників: Ag, Cu, Bi, Re, Rh і ін.
4. Метали високої термодинамічної стабільності ( 0,814 В < ЕМе/Меn+ < 1,23 В) не кородують в нейтральних середовищах за наявності в них кисню: Pt, Pd, Ir і ін.
5. Метали практично повної термодинамічної стабільності (ЕМе >1,23 В) стійкі в кислотних середовищах навіть за наявності кисню, проте можуть кородувати в розчинах комплексоутворювачей за наявності окисників: Аu.
Таке ділення металів корелює з їх положенням в Періодичній системі елементів: найбільш корозійностійкі розташовуються внизу груп перехідних елементів ( Os, Ir, Pt, Au ). У побічних підгрупах ( IV В, VI В, VII В) знахо-дяться легко пасивовані метали, причому із зростанням порядкового номера їх пасивність в підгрупі зростає.
Таким чином, якщо порівняти рівноважні потенціали металу і потен-ційного окисника, можна зробити висновок про вірогідність корозійного про-цесу.
2.5. Кінетика електрохімічної корозії
Електрохімічна корозія є сукупністю двох зв'язано протікаючих гетеро-генних реакцій: анодного окиснення металу і катодного відновлення деполяри-затора (окисного компонента коррозіоной середовища). Кожна з них є багатостадійною, в якій одна із стадій лімітуюча.
Оскільки катодна і анодна реакції протікають взаємозв'язано, то уповільнення однієї гальмує іншу. Таким чином, загальна швидкість всього корозійного процесу визначатиметься швидкістю лімітуючої стадії або катодною (катодний контроль), або анодною (анодний контроль) реакцією. Оскільки корозійні ГЕ є короткозамкнутими, а електрохімічна корозія найчастіше протікає в середовищах з високою іонною провідністю, то ні стадія переміщення електронів всередині металу, ні стадія дифузії іонів в розчині не можуть бути лімітуючими.
Швидкість електрохімічної корозії визначається силою струму, що протікає через електрод. Для характеристики швидкості електродних процесів використовують значення щільності струму i :
i = I /S
Оскільки електрохімічні реакції є різновид гетерогенних процесів, швид-кість електродного процесу визначається як кількість речовини, що реагує на одиниці площі поверхні електроду в одиницю часу. З врахуванням законів Фарадея:
Кm = m / V S t = I / n FS= i / nF ,
де Кm – швидкість електродного процесу, моль/(м2 с); i - щільність струму,А/м2 ; S - площа поверхні електроду, м2. З цього виходить, що
i = nF Кm
В стані рівноваги швидкості катодного і анодного процесів рівні, отже, рівні і щільності струму, що протікає при відновленні ik і окисненні ia:
ik= ia = i0 .
де i0 - щільність струму обміну, залежна від природи електродного процесу, активності речовин – учасників реакції і температури.
Про швидкість електрохімічного процесуможна судити по зміні маси анода або об'єму окисника на катоді.Масаактивнішого електроду, що розчинився, або об'єм речовини, що виділилася, на катоді визначається наступним співвідношенням (закон Фарадея):
m =Mэкв ×I ×t / F или V = Vэкв ×I ×t / F
де I — сила струму, А; m — маса речовини, що розчинилася на аноді, г ; V - об'єм речовини, що виділилася, на катоді, л; F — постійна Фарадея (96500 Кл); Mеекв—молярна маса еквівалента елементу, з якого зроблений активніший електрод, г/моль; Vекв - еквівалентний об'єм газу, що виділяється на катоді, л/моль (Vэкв(Н2) = 11,2 л/моль) ; t – час корозії, с.
2.6. Поляризація. Деполяризація .
Відхилення потенціалів електродів від їх рівноважних значень при робо-
ті гальванічної пари називається поляризацією.
Будь-який електрохімічний процес складається з наступних стадій:
- підведення реагир. речовин до поверхні електроду з об'єму розчину;
- адсорбція реагуючих частинок на поверхні електроду;
- перенесення заряджених частинок ( електронів або іонів) через кордон розділу фаз ( електрохімічна реакція);
- відведення продуктів реакції в об'єм розчину або утворення нової фази (газоподібної або твердої).
При миттєвому протіканні цих стадій поляризація як явище була б від-сутня, проте на практиці вони йдуть з кінцевими швидкостями. Найповільніша стадія (лімітуюча) визначає швидкість всього електродного процесу і є причи-ною поляризації. Якщо лімітуюча стадія відома, замість терміну «поляризація» використовують термін «перенапруга». Поляризація виникає внаслідок нижчих швидкостей протікання електродних реакцій, чим швидкість пересування електронів.
Речовини, які знижують анодну або катодну поляризацію називаються деполяризаторами.
2.6.1 Анодна поляризація
Анодна поляризація - це зсув потенціалу анода в позитивну сторону при проходженні анодного струму:
Ра = Еа – Еа1
изм. равн.
Залежно від причин, що викликають анодну поляризацію, розрізняють 3 основних випадки:
1) Концентраційна поляризаціявикликається невеликою швидкістю дифузії іонів металу у розчині електроліту, внаслідок чого утворюється підви-щена концентрація катіонів металу в прианодній зоні.
Еконц. = 0,059/n lg с2/с1, де с2 и с1 – більша і менша концентрація катіонів металу в розчині електроліта.
Концентраційна поляризація зменшується , якщо зростає коєфіціент дифузії, температура і концентрація реагента, а також зі зменшенням щільності струму і товщини дифузійного шару.
2) Перенапруження іонізації металу( активаційна поляризація) - гальмуванняанодного процесу внаслідок утруднення протікання безпосередньо реакції іонізації металу (вихід іонів металу в розчин не встигає за відведенням електронів).
Згідно з теорією уповільненого розряду А.М.Фрумкіна та ін. швидкість процесу корозії з’вязана з енергією активації: електрохімічна реакція відбувається в тому разі, якщо середня енергія реагуючих часток більше або дорівнює енергії активації. Енергія активації залежить від значення потенціалу і відповідно від електрохімічного перенапруження.
При малих значеннях щільності струму - мале перенапруження, система трохи відхиляється від рівноваги. При цьому енергія активації велика, а швид-кість процесу в обох напрямах низька. Із збільшенням потенціалу константа швидкості процесу відновлення зменшується, а константа швидкості процесу окиснення збільшується.
Авторами теорії уповільненого розряду було показано, що при проход-женні через ЕХС значного струму залежність електрохімічного перенапру-ження η від щільності струму і визначається рівнянням

щільність струму обміну iо і коефіціент переносу α — кінетичні параметри процесу. З введенням позначень

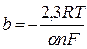
рівняння перетвориться в наступне
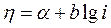
Це рівняння було експериментально отримано Тафелем в 1905 р. і названо його ім'ям. Величини а і b називають тафелевими константами. Константа а чисельно дорівнює значенню електрохімічної поляризації при одиничній щіль-ності струму. Тафелеві константи можна визначити за графіком, який в координатах lg i - η є прямою лінією (мал. ). Значення а відповідає відрізку, що відсікається прямою на осі ординат при lg i = 0, величина b — тангенсу кута нахилу а прямій до осі абсцис.
Рівняння Тафеля відображає вплив матеріалу електроду на пере-напруження, оскільки постійні а і b неоднакові для різних металів.
Очевидно, що для вибору оптимальних умов проведення електро-хімічних процесів необхідно визначити найбільш повільну стадію, вивчити її природу.
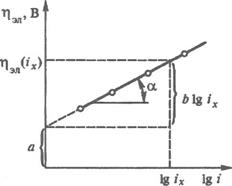 Мал. Залежність електрохімічної поляризації електроду від логарифма щіль-ності струму.
Мал. Залежність електрохімічної поляризації електроду від логарифма щіль-ності струму.
|
З'ясування механізму лімітуючої стадії електродного процесу дозволяє підібрати спеціальні речовини — депо-ляризатори, введення яких в електроліт або матеріал електроду дозволяє змен-шити величину електродної поляризації, тобто приводить до ослаблення поляризаційних явищ (деполяризації).
Перенапруження - це різниця між потенціалом електроду, через який пропускається струм, і рівноважним потенціалом електродної реакції.
3) Анодна пасивність. Значне гальмування анодного процесуможе спостерігатися внаслідок настання явища анодної пасивності металу, тобто різкого гальмування анодного процесу при досягненні анодом певного потенціалу пасивування, в результаті утворення на поверхні анода адсорбційних або фазових пасивних плівок.
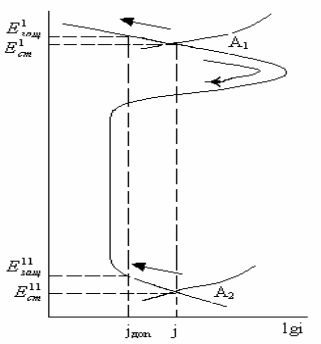
Мал. 6. Потенціостатична анодна поляризаційна крива:
1 - область активного розчинення металу; 2-активно-пасивного стану металу; 3-пасивний стан металу; 4-порушення пасивного стану металу; (а -пітінгоутворення, 6 - перепасивація) (E н.п. и і н.п. — потенціал і струм початку пасивації; En.п. и іп.п. — потенціал і струм повної пасивації; Епіт. —потенціал пітінгоутворення; Епер. — потенціал перепасивації).
В цьому випадку розчинення металу сильно зменшується і потенціал металу зрушується у бік позитивних значень.
Розрізняють декілька областей потенціалів, в яких протікає анодна реак-ція корозійного процесу (мал. 6). Ділянка 1а анодної поляризаційної кривої від-повідає активному стану металу. Особливістю анодних реакцій корозійного процесу в області активного розчинення є те, що вони складаються з декількох стадій, в яких беруть участь компоненти розчину.
Пасивний стан металів і сплавів
Ряд металів - Fe, Cr, Ni, Ti, Al, Zr, Mo, Ta, Mg, Со в концентрованих розчинах окисників руйнуються значно менше, ніж в слабкіших розчинах - відбувається пасивація металів. Метал в даному випадку називають пасивним. Таким чином, пасивний стан характеризується високою корозійною стійкістю, викликаною гальмуванням анодної реакції іонізації металу впевній області потенціалу (див. мал. 6, ділянка 3). Зниження швидкості корозії відбувається в результаті утворення на поверхні металу фазових або адсорбційних шарів, гальмуючих анодний процес, воно починається при потенціалах області актив-но-пасивного стану (ділянка 2).
В процесі пасивації відбувається різка зміна електродного потенціалу металу в позитивну сторону. Наприклад, залізо в активному стані має потенціал біля —0,4 В, а в пасивном у + 1,0 В. Така зміна електродного потенціалу вказує на гальмування анодного процесу електрохімічної корозії.
Пасивність залежить від складу, структури і стану поверхні металу і сплаву, концентрації агресивного середовища, температури, накладення постій-ного струму, рухи розчину і так далі
Створити пасивний стан можливо зміною складу сплаву, зовнішніх умов і складу агресивного середовища, дотичного з металом. Легко пасивують метали і сплави окисники-пасиватори: водні розчини HNO3, KMnO4, K2Cr2O7, H2O2, аеровані розчини електролітів та ін.
Здібність до пасивації залежить від властивостей металу. Так, нікель легко переходить в пасивний стан під дією деяких органічних (оцтова, лимонна, щавлева) і мінеральних (борна, ортофосфатна) кислот і в розчинах ряду ней-ральних солей; алюміній - в концентрованих розчинах нитратної і хромової кислот; хром- в розбавленій нитратній кислоті.
Всі вказані метали пасивуються значно легше, ніж залізо, тому при вве-денні до складу залізовуглецевих сплавів металів (Cr, Al, Ni), що легко паси-вуються, отримують сплави, корозійна стійкість яких близька до стійкості легу-ючого елементу, хоча його вміст в сплаві невеликий.
Слід зазначити, що метал, що знаходиться в пасивному стані, втрачає деякі свої властивості; наприклад, залізо, що пасивує, не витісняє мідь з розчи-нів її солей. Крім того, запасивоване в концентрованій HNO3 залізо стає стійким і в розбавленій HNO3 кислоті, у воді, в деяких інших середовищах і після сушки в сухому повітрі.
Метал, що пасивує, або сплав при зміні зовнішніх чинників, пов'язаних з властивостями електроліту, може знов ставати активним.
Процес переходу металу з пасивного стану в активне називають актива-цією. Речовини або процеси, що викликають цей перехід, називаються актива-торами. Активацію можуть викликати відновники (H2, Na2SO3, Na2S2O3), деякі іони (Н-, Сl-, Br-, F-, SO42-), катодна поляризація, підвищення температури, пору-шення цілісності пасивної плівки на поверхні металу. В присутності, наприк-лад, іона хлора наступає порушення пасивного стану при потенціалі пітингоут-ворення за реакцією
Ме + 2Сl- - 2е- ↔MеCl2
Метал кородує з утворенням точкових продуктів корозії (пітингів).
Залежно від властивостей і концентрації пасиватора і активатора в розчині можливі періодичні переходи поверхні металу з активного стану в пасивний, і навпаки.
Пояснюється це тим, що внаслідок конвекції розчину поверхня металу стикається періодично з порціями рідини, що містять або великі кількості пасиватора, або активатор.
Механізм процесу пасивації складний і недостатньо вивчений. Найширше визнано дві теорії пасивності: плівкова і адсорбційна.
За плівковою теорією пасивність металів у водних розчинах електролітів пояснюється створенням на поверхні металу якнайтонших електропровідних захисних плівок - продуктів взаємодії металу з окисниками або іншими сполу-ками.
Такі захисні плівки можуть утворитися і в результаті анодної поляриза-ції, особливо в тих випадках, якщо в сплав введений елемент, що легко пасиву-ється. Анодна пасивність є результатом утворення на поверхні металу нероз-чинних продуктів:
Слід підкреслити, що корозійна стійкість металу в пасивному стані залежить від будови, товщини, пористості захисної плівки і її стійкості в даному середовищі.
Плівкова теорія не пояснює великого числа явищ, що спостереджуються при пасивації.
За адсорбційною теорією пасивність металу пояснюється виникненням на його поверхні мономолекулярних шарів кисню, який насищає валентності всіх або найбільш активних поверхневих атомів металу, тобто утворюється неактивний поверхневий шар металу.
Причому при пасивності не обов'язкове заповнення всієї поверхні металу адсорбційним шаром кисневих атомів. Це необхідно тільки на активних ділян-ках поверхні, наприклад по вузлах і ребрах кристалічної решітки.
Молекули кисню, що викликають пасивацію металу, утворюються з молекул води або іонів гідроксила, що спочатку адсорбуються на поверхні металу.
Як вказувалося вище, метал може переходити в пасивний стан під дією окисників або анодної поляризації. Але він зберігає свою пасивність тільки при певній концентрації окисника або при певному значенні потенціалу металу при його анодній поляризації.
Так, низьколегована і високолегована сталі стійкі до азотної кислоти при концентраціях від 30 до 90 %, і їх пасивують саме при цих концентраціях, але підвищення концентрації HNO3 до 94 % приводить вже до руйнування сталей. Таким чином, в сильно окисних корозійних середовищах або при дуже сильній анодній поляризації відбувається порушення пасивності металу, що називається перепасивацією.
До перепасивації схильні низьколеговані сталі в концентрованій нитратній кислоті, неіржавіючі сталі - в 30 %-ній HNO3 з добавкою K2Cr2O7 при температурі вище 500C. Перепасивацію деяких металів викликають розчини сульфатної кислоти і її солі.
Здатність багатьох металів пасивуватися широко використовують в техніці, наприклад вироби з алюмінію застосовують у воді і повітрі, з титану - в агресивних середовищах.
Перевести метали і сплави в пасивний стан можна наступними способами:
1. Легуванням металу іншим металом (пониження анодної активності), що легко пасивується, наприклад вуглецевої сталі - хромом, спільно хромом і нікелем; нікеля - хромом і т.п.
2. Легуванням металу іншим металом, що підвищує швидкість катод-ного процесу, наприклад заліза - міддю; легованих сталей - платиною, пала-дієм, міддю; титану - платиною; цирконію - палладієм і так далі.
3. Застосуванням електрохімічного захисту і інгібіторів корозії.
4. Застосуванням катодних покриттів.
2.6.2. Катодна поляризація
Катодна поляризація - це зсув потенціалу катода в негативну сторону при проходженні катодного струму.
- Пк =Ек - ЕОх
изм. равн.
Ця поляризація обумовлена:
1) перенапруженнямкатодної реакції, тобто сповільненістю процесу
Ох+ пе- = Охn- ;
2) концентраційною поляризацією, тобто недостатньою швидкістю підведення або відведення початкових або кінцевих продуктів реакції на катоді.
Речовини, які знижують анодну або катодну поляризацію називаються
деполяризаторами.
Процеси катодної деполяризаціїв більшості практичних випадків коро-зії здійснюються або шляхом розряду на катоді іонів водню по реакції ( кисле середовище):
2H+ +2 e- = H2
або шляхом іонізації кисню по реакції (нейтральне середовище):
O2 + 2H2O + 4e- = 4OH-
а) Киснева деполяризація (перенапруження кисню)
Процес кисневої деполяризаціїзазвичай значно гальмується перенесен-ням киснюдо катода - концентраційною деполяризацією по кисню. В разі перемішування розчину гальмування в результаті перенапруження реакції іонізації кисню на даному матеріалі катода має значний вплив на кисневу деполяризацію.
Стадії протікання процесів з кисневою деполяризацією :
- розчинення О2 повітря в електроліті;
- перенесення О2 в об'ємі електроліту ( конвекція або перемішування);
- дифузійне перенесення О2 в дифузійному шарі до катодних ділянок металу;
- іонізація кисню;
- дифузія і перенесення іонів ОН- від катода вглиб розчину.
При корозії металів з кисневою деполяризацією найбільш утрудненими стадіями катодного процесу є: в спокійних електролітах – дифузія кисню, при дуже великих швидкостях підведення кисню до кородуючого металу – іонізація кисню. Часто спостерігається сумірна загальмованість цих стадій.
В цьому випадку електрохімічну поляризацію катода називають перенапруженням кисню ή О2 .
ή О2 = ЕО2 - ЕО2 рівн.
ή О2 залежить від ί к , матеріалу катода і стану його поверхні, температури і ін.
Криві, які відображають зміну потенціалу при проходженні струму, або, навпаки, зміна струму із зміною потенціалу, називають поляризаційними кривими (анодними або катодними, мал. ).




|
|
|
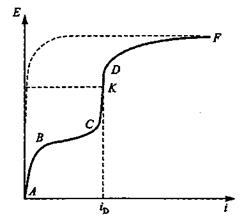
Загальний вид поляризаційної кривої в координатах Е- і представлений на рис.1. Ділянка АВС відповідає відновленню О2, відрізок СК - точці визначення граничного дифузійного струму iдиф. Відрізок СК характеризує відновлення О2 на граничному дифузійному струмі.
Після досягнення граничного струму (точка K на мал. 1) процес катодної деполяризації гальмуватиметься тільки із-за концентраційних утруднень. В цьому випадку поляризаційна крива піде вгору поки не буде досягнутий потенціал якогось нового процесу на катоді. Ділянка КDF відповідає загальному процесу відновлення О2 і виділення Н2 .
Дата добавления: 2015-11-06; просмотров: 947;
