Поляризационные кривые
Кривые, которые отображают изменение потенциала при прохождении тока, или, напротив, изменение тока с изменением потенциала, называют поляризационными кривыми (анодными или катодными).
|

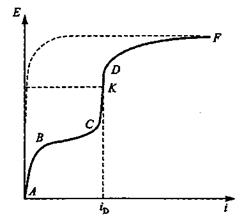
Общий вид поляризационной кривой в координатах Е- і представленный на рис.1. Участок АВС отвечает восстановлению О2, отрезок СК - точке определения предельного диффузионного тока iдиф. Отрезок СК характеризует восстановление О2 на предельном диффузионном токе.
По достижении предельного тока (точка K на рис. 1) процесс катодной деполяризации будет тормозиться только из-за концентрационных затруднений. В этом случае поляризационная кривая пойдет вверх пока не будет достигнут потенциал какого-то нового процесса на катоде. Участок КDF отвечает общему процессу восстановления О2 и выделения Н2 .
Величина предельного тока может быть существенно повышена интенсивным перемешиванием растворов, аэрацией, введением в электролит окислителей, которые легко восстанавливаются на катоде (Н2О2, (NH4)2 S2O8), или переносчиков оксигена (Fe3+ — Fe2+, Сu2+— Сu+), которые выступают в роли деполяризаторов(вещества, которые уменьшают поляризацию):
Fe3+ + е- ↔ Fe2+.
Анализируя состояние коррозийной системы с помощью диаграмм
lg і = f(E), можно определить, как необходимо изменить потенциал кородирую-
щего металла, чтобы ускорить или затормозить коррозию.
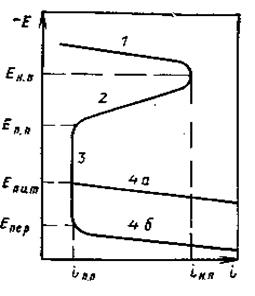
Рис. 6. Потенциостатическая анодная поляризационная кривая:
1 — область активного растворения металла; 2—активно-пассивное состояние металла; 3—пассивное состояние металла; 4—нарушение пассивного состояния металла; (а —питтингообразование, 6— перепассивация) (E н.п. и і н.п. — потенциал и ток начала пассивации; En.п. и іп.п. — потенциал и ток полной пассивации; Епит. —потенциал питтингообразования; Епер. — потенциал перепассивации).
|
Скорость анодных реакций может уменьшаться из-за замедленности перехода металла в раствор в виде ионов (перенапряжение ионизации металла) или в результате замедленности диффузии их в глубь раствора от поверхности. Причиной анодной поляризации может быть также образование защитных пленок на металле при его взаимодействии с компонентами электролита. В этом случае растворение металла сильно уменьшается и потенциал металла сдвигается в сторону положительных значений.
Различают несколько областей потенциалов, в которых протекает анодная реакция коррозионного процесса (рис. 6). Участок 1а нодной поляризационной кривой отвечает активному состоянию металла. Особенностью анодных реакций коррозионного процесса в области активного растворения является то, что они состоят из нескольких стадий, в которых принимают участие компоненты раствора.
Дата добавления: 2015-11-04; просмотров: 14309;
