ВЛИЯНИЕ ВНУТРЕННИХ И ВНЕШНИХ ФАКТОРОВ
НА СКОРОСТЬ КОРРОЗИИ
Внутренние Внешние
1. Хим. состав сплава 1. Хим. активность среды, рН
2. Структура мет. 2. Температура.
3. Состояние поверхности 3. Давление
4. Условия эксплуатации 4. Скорость движ. электролита.
5. Концентрация эл-та.
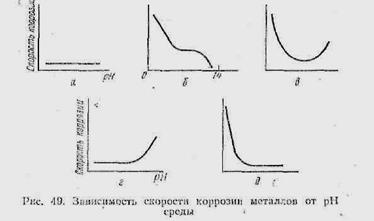
Влияние рН среды
| металл | Устойчивость в кислой среде | Устойчивость в щелочной среде | Устойчивость в нейтр. среде | |
| рН=до 4 | 4 - 8,5 | >10 | ||
| Fe | малост., прод кор. раств. | скор. не завис. от рН | нераств . гидрокс. скорость резко падает >14 раств. ферриты, скор. растет | |
| Mg | малост., прод кор. раств. | - - - | ||
| Cu | малост, прод кор. раств. | - - - | ||
| Mn | малост., прод кор. раств. | - - - | ||
| Al,Sn,Pb,Zn | неустойчив | неустойчив | устойчив | |
| Mo. Tn.W | устойчив | неустойчив | ||
| Ni. Cd | неустойчив | устойчив | ||
Ag. Au. Pt –высокая стойкость во всех средах, скорость кор. не зависит от рН среды.
К внугренним факторам, определяющим скорость, характер злектрохимической коррозии, относятся состояние поверхности, химический состав и структура металла и т. д. Неоднородность повсрхиости металла являєтся одной из причин местной коррозии. Тщательиая, тонкая обработка поверхности (шлифовка, полировка) повышает коррозионную стойкость металлов, способствуя образованию более однородной сплошной оксидной пленки на поверхности металла. При грубой обработке истинная поверхиость контакта металла с агрессивной средой увеличиваетея, что усиливает коррозию.
Вшешние фактори, влияющие на скорость коррозии металлов, определяются природой и свойствами коррозиониой среды и ее параметрами (температура, давление, скорость движения раствора электролита и т. д.
Влияние рН среды. Концентрация ионов водорода в растворе электролита определяет скорость электрохимической коррозии металлов. Для благородних метал лов (серебра, золота, платины) характерна високая коррозионная стойкость в кислых, нейтральных и щесредах,лочных т. е. скорость коррозии для этих металлов за
 |
висит от рН среды . К металлам малостойким в кислых средах относятся железо, магний, медь, марганец . При невысоких значеннях рН скорость их разрушения велика: легко выделяетея водород, продукты, образующиеся в результате коррозии, растворимы.
При рН от 4,0 до 8,5 скорость коррозии зтих металлов не зависит от рН, так как в зтих условиях не меняетея растворимость кислорода, основного катодного деполяризатора.
В щелочннх средах (рН>10), если рассматривать зависимость = (рН) для железа, происходит образование нерастворимых гидроксидов, и скорость коррозии резко падает. При очонь высоких концентрациях гидроксид-ионов (рН>14) образуются растворимые ферриты и гипоферриты железа, скорость коррозии при зтом возрастает.
Цинк, алюминий, олово, свинец устойчивы в нейтральных средах, но разрушаются в щелочных и кислых средах (рис. 4) Неустойчивость этих металлов в кислых и щелочных средах объясняется их амфотериостью, т. е. растворимостью оксидов зтих металлов в кислотах и щелочах. К металлам, устойчивым в кислых, по нестойким в щелочных средах, относятся молибден, тантал, вольфрам (рис. 49). К металлам, малостойким в кислих средах, но устойчивым в щелочных, относятся никель, кадмий (рис. 49,). Для каждого металла имеется определенное значение рН раствора электролита, при котором скорость коррозии минимальна, например, для алюминия — 7,0; свинца — 8,0; олова — 9,0; цинка — 10,0; железа— 14,0.
2.12.2. Влияние температуры на скорость коррозии. Измеиение температури внешней среды значительно влияет на скорость коррозии, так как увеличивается скорость диф-фузии, растворимость продуктов коррозии, величина перенапряжения на электродах. При повышенни температуры среды скорость электрохимической коррозии, как
правило, возрастает (рис. 50, а). В зтом случае зависимость скорости коррозии от температури Т выражается уравнением следующего вида:
K = Ae -Q/RT , где
где А— константа; е— основание натуральных логарифмов; — величина энергии активации; — молярная газовая постояиная. После логарифмирования уравнение носит линейннй характер: 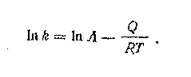
Такой вид зависимоєти справедлив для скорости коррозии неблагородных металлов в мннеральных кислотах , т. е. в процессах, протекающих с водородной деиоляризацией. Возможны исключения из указанного правила, что связано с появлением защитных свойств у продуктов коррозии или уменьшением растворимости кислорода в электролите с повышением температуры в открытых системах.
2.12. 3.Влияние давления на скорость коррозии. Основная причина влияния давлення на скорость электрохимической коррозии — изменение растворимости газа, участ-вующего в зтом процессе. Позтому при увеличении давления увеличивается скорость коррозионных процессов, идущих с кислородной деполяризацией, и давление не влияет на процессы, идущие с водородной деподяризацией. Повышение давления и температуры увеличивает скорость коррозии (карбонильная коррозия углеродистых сталей).
2.12.4. Влияние скорости движения электролита на скорость коррозии.
Кажднй прибор, атшарат и т. п. работает в ус|ловиях, когда раствор злектролита перемещаетея или перемешивается. При перемещении злектролитов, не имеющих в своем составе значительних количеств агрессивных ионов, зависимость скорости коррозии от скорости потока жидкости можно представить кривой (рис. 51) с
тремя характерными участками: 1 — с увеличением скорости движения раствора злектролита скорость коррозии увеличивается, так как увеличивается скорость диффузии кислорода к поверхности контакта металл — электролит; 2 — ско-
рость коррозии умеиьшается, так как на поверхпости металла образуется защитная оксидная пленка; 3 — скорость коррозии резко возрастает из-за 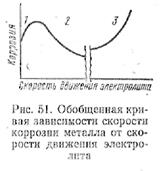
мехапического удаления защитной пленки (эрозии) движущимся потоком электролита.
Скорость движения электролита значительно влияет на процесе коррозии, протекающий с кислородной деполяризацией, чем с водородной. Если при движении электролита на отдельных участках иоверхности металла чередуетея низкое и высокое давление, то наблюдается усиленное разрушение не только защитных пленок, но и металлической поверхности. Зто явление называют кавитационной эрозией. Такой вид разрушения характерен для втулок цилиндров дизелей со стороны, охлаждаемой водой, гребных винтов, лопастей гидравлических турбин.
Разрушения, вызванные кавитационной эрозией, проявляются в виде трещин, углублений, раковин. Агрессивнмость среды благоприятствует разрушению металла кавитационной эрозией.
2.12.5. Влияние состава нейтральних растворов. С повишением концентрации раствора скорость коррозии виачале растет, а затем падает. Такая зависимость являетея ти-пичной для процессов коррозии металлов в нейтральных растворах солей (рис. 52). Поскольку процесс коррозии в этом случае.зависит от кислородной деполяризации, повышение скорости коррозии нельзя об'ьяснить только влиянием растворенного кислорода, так как растворимость кислорода снижается при повышении концентра-| ции соли в растворе. Наличие восходящей ветви на указанной зависимости связано с увеличением электропроводности раствора и соответствующей активизацией анодного процесса. При повышении концеитрации соли в растворе выше 3% №С1, дальнейшєе поиижеиие раст воримости кислорода становится превалирующим факто- ром, и скорость коррозии снижается.
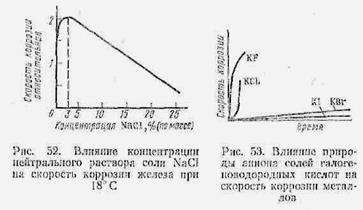
Растворы солей других щелочных металлов (например, КС1 ) влияют на скорость коррозии аналогичным образом. Растворысолей щелочноземельных металлов несколько менее коррозионно активны, чем соли щелочных металлов.
На процесе коррозии большинства металлов в растворах солей существенно влияет природа аниона соли (рис. 53). Растворы этих солей не способствуют образо-ванию защитной нерастворимой пленки на поверхности металлов (исключая ионы СІ" для молибдена и ионы для магния). Наиболее агрессивными являютея растворы, содержащие фторид-.ионы, и замыкают группу растворы, содержащие иодид-ионн.
Дата добавления: 2015-11-04; просмотров: 5763;
