Кинетика электрохимической коррозии
О скорости электрохимического процесса можно судить по изменению массы анода илиобъему окислителя на катоде.Масса растворившегося более активного электрода или объем выделившегося вещества на катоде определяется следующим соотношением (закон Фарадея):
m =Mэкв ×I ×t / F или V = Vэкв ×I ×t / F (8)
где I — сила тока, А; m — масса растворившегося вещества на аноде, г ; V - объем выделившегося вещества на катоде, л; F — постоянная Фарадея, Кл; M экв—молярная масса эквивалента элемента, из которого сделан более активный электрод, г/моль; Vэкв - эквивалентный объем элемента, л/моль; выделяющегося на катоде л/моль; t – время коррозии, с.
Пример 5. Вычисление массы металла, окисляющегося при коррозии.
При нарушении целостности поверхностного слоя медного покрытия на алюминии протекает процесс коррозии вследствие работы гальванопары:
(А-)2Al/2Al3+ ï H2SO4 ï 3H2/6H+ (Cu) (К+)
За 45 с работы этой гальванопары на катоде выделилось 0,09 л водорода (измеренного при н. у.). Какая масса алюминия растворилась за это время, и какую силу тока дает эта гальванопара?
Решение.Эквивалентный объем О2 составляет 11,2 л. Гальванический элемент дает ток силой:
I = V×F/ (Vэкв ×t )=( 0,09 × 96500) / (11,2 × 45) = 17,2 А .
Mэкв(Аl) = 27/3 =9 г/моль. За 45 с работы гальванопары растворилось:
m (Аl ) = ( 9 × 17,2 × 45)/ 96500 = 0,072 г.
Важным признаком электрохимических реакций является эквивалентность скорости реакции плотности тока. Если выразить
I = ia ×S,
где ia – плотность анодного тока, S – площадь поверхности образца, то пользуясь законом Фарадея, можно рассчитать ia :
ia = (n×F× m) / (S ×A ×t),
где А –атомная масса металла.
Диаграмма Пурбе.
Для характеристики термодинамической устойчивости электрохимических систем в водных растворах можно использовать диаграмму потенциал — рН (диаграмму электрохимической устойчивости воды). На диаграмме (рис. 3) приведены линии равновесного потенциала водородного (линия 1)и кислородного (линия 2) электродов и отмечены значения стандартных потенциалов некоторых металлов. Металлы, потенциалы которых расположены ниже линии 1,могут корродировать под действием окислителей H+ (H3O+) и растворенного O2.
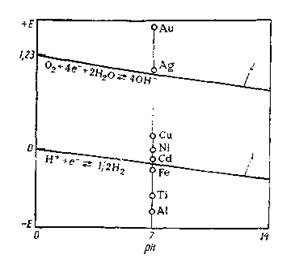 |
Рис. 3. Диаграмма электрохимической устойчивости воды при 25 0C
Если потенциал металла находится между линиями 1 и 2, то окислителем, вызывающим коррозию металла, будет только растворенный кислород
Коррозию благородных металлов, равновесный потенциал которых находится выше линии 2, могут вызвать только сильные окислители с равновесным потенциалом более положительным, чем у оксигена и иона гидрогена.
Таким образом, сопоставляя равновесные потенциалы металла и предполагаемого окислителя, можно сделать вывод о вероятности коррозионного процесса.
 |
2.7. УСЛОВИЯ ВОЗНИКНОВЕНИЯ КОРРОЗИОННОГО ПРОЦЕССА
Уравнение Нернста позволяет рассчитать значение потенциала металла, погруженного в раствор собственных ионов. В этом случае происходит обмен ионами между металлом и раствором
Мп+ + пе = M,
и скорость восстановления ионов металла, выраженная через плотность тока іразр. (ток прямой реакции, ток разряда), равна скорости растворения металла іиониз.(ток обратной реакции, ток ионизации).
Скорость обмена ионами металла между металлом и раствором при равновесном потенциале называют током обмена іобм.
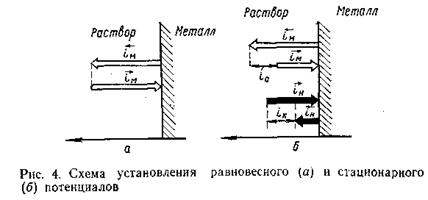
Схема установления равновесного потенциала показана на рис. 4, а. Примером электрохимических систем, в которых устанавливается равновесный потенциал Еравн., является Ag в растворе AgNO3.
Таким образом, при установлении равновесного потенциала границу металл — раствор пересекает только один вид ионов — катионы металла. При этом наблюдается баланс по зарядам и баланс по веществу, т. е. коррозия отсутствует.
В реальных условиях во взаимодействии металла и электролита участвуют не только катионы данного металла, но и другие ионы (или молекулы). Установившееся при этом значение потенциала называется неравновесным, или необратимым.В таких условиях анодная реакция обеспечивается в основном ионами металла, а катодная— другими ионами, например, ионами водорода, присутствующими в электролите. Необратимый потенциал возникает, например, при погружении цинка в раствор серной кислоты Zn/H2SO4. B этом случае анодная реакция заключается в растворении цинка:
Zn – 2 e- = Zn2+
а катодная — в выделении водорода:
2H+ +2 e- = H2
Значения необратимый потенциалов определяют опытным путем, так как их нельзя рассчитать по уравнению Нернста.
Установившееся значение необратимого потенциала в результате равенства суммарных скоростей можно измерить по плотности тока катодных и анодных процессов
Установившийся в данном случае потенциал называется стационарнымпотенциалом коррозии .
Таким образом, при потенциале коррозии соблюдается баланс электрических зарядов , но происходит изменение массы металла в результате электрохимического растворения (коррозии) его .
На значение необратимого потенциала влияют:
температура, перемешивание раствора и концентрация его, природа и состояние поверхности металла.
Необратимые потенциалы определяют скорости электрохимической коррозии. Чем более отрицательное значение имеет потенциал металла, тем больше возможность перехода металла в ионное состояние, т. е. скорость электрохимического растворения.
Потенциал коррозии Екор и ток коррозии iкорявляются основными характеристиками коррозионного процесса.
Дата добавления: 2015-11-04; просмотров: 4381;
