ЗАМЕДЛИТЕЛИ ( ИНГИБИТОРЫ) ЭЛЕКТРОХИМИЧЕСКОЙ
КОРРОЗИИ МЕТАЛЛОВ
Замедлителямиили ингибиторами коррозии называют вещества, которые при введении их в коррозионную среду в незначительном количестве заметно снижают скорость электрохимической коррозии металла или сплава.
По своей природе замедлители коррозии бывают ионными или молекулярными соединениями.
Замедлители адсорбируются на поверхности корродирующего металла электростатически (адсорбция ионов и полярных молекул за счет кулоновских сил при соответствующем знаке заряда поверхности металла) или специфически (адсорбция поверхностно активных ионов и молекул за счет молекулярных вандерваальсовых сил), или химически (хемосорбция ионов и молекул за счет валентных сил химического сродства); возможна также адсорбция их вследствие одновременного действия разных сил.
По механизму тормозящего действия на электрохимический процесс коррозии замедлители подразделяют на анодные, катодные, экранирующие (пленкообразователи) и смешанные.
Замедлители, адсорбируясь на поверхности корродирующего металла, или тормозят протекание анодного или катодного процесса электрохимической коррозии, или, образуя экранирующую пленку, изолируют металл от электролита, или имеют смешанный характер замедляющего действия.
По составу различают неорганические и органические замедлители коррозии. Присутствие в органических замедлителях полярных атомов _N, S_способствует их адсорбции на поверхности металлов.
Анодные замедлители электрохимической коррозии металлов— окислители (пассиваторы): кислород, нитриты, хроматы и др. — замедляют коррозию, пассивируя металлы, т. е. затрудняя протекание анодного процесса.
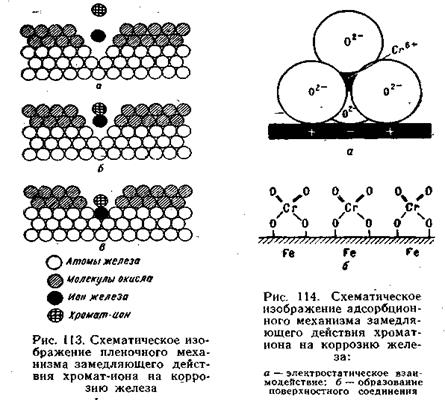
На рис. 113 дана схема пленочного механизма замедляющего действия хромат-иона на коррозию железа: хромат-ион реагирует с ионом железа, возникшим в поре защитной оксидной пленки (рис. 113,а), и образует нерастворимое соединение (рис. 113,6), которое, осаждаясь, закрывает пору и препятствует коррозии железа (рис 113, в).
На рис. 114, а приведена схема адсорбционного механизма действия того же аниона, который содержит ион хрома и тетраэдрически расположенные вокруг него четыре иона кислорода: расположение зарядов таково, что центр иона очень положителен и притягивает электроны на поверхности железа, что до некоторой степени придает неподвижность электронам, а ионы кислорода оказывают такое же действие на ионы металла, что задерживает коррозию железа.
По мнению ряда исследователей, адсорбционное взаимодействие хроматов с железом сопровождается образованием поверхностного соединения (рис. 114, б).
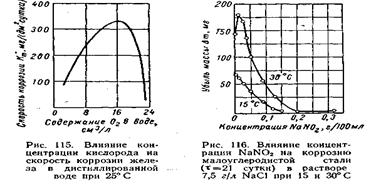
При недостаточной концентрации анодных, замедлителей для наступления полной пассивности металла (особенно в присутствии активных депассивирующих ионов, например ионов С1-) они являются опасными, так как могут вызвать ускорение общей или местной коррозии, действуя как катодные деполяризаторы (рис. 115 и 116).
Катодные замедлители электрохимической коррозии — вещества, повышающие перенапряжение катодно-
го процесса при их адсорбции на катодных участках поверхности корродирующего металла: соли или окислы мышьяка и висмута , желатина (рис. 117), агар-агар, декстрин, и многие другие органические вещества замедляют коррозию в растворах неокислительных кислот, повышая перенапряжение водорода. Катодные замедлители безопасны, так как при недостаточной концентрации в растворе они ' не вызывают усиления коррозии.
 Катодные замедлители коррозии в ряде случаев уменьшают также наводороживааие металла при его кислотном травлении, что снижает опасность возникновения травильной хрупкости.
Катодные замедлители коррозии в ряде случаев уменьшают также наводороживааие металла при его кислотном травлении, что снижает опасность возникновения травильной хрупкости.
Иногда к катодным замедлителям электрохимической коррозии металлов относят поглотители кислорода; сульфит натрия , гидразин-гидрат и другие восстановители понижают скорость коррозии металлов с кислородной деполяризацией в нейтральных растворах, связывая деполяризатор — кислород по реакциям
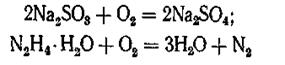
и тем самым уменьшая его содержание в растворе.
Экранирующие замедлители электрохимической коррозии металлов, адсорбируясь на металле, образуют хемосорбционный слой (например, ионы галоидов на нержавеющей стали Х18Н9 при ее травлении в растворах _H2SO4_ с добавками этих ионов) или чаще защитную пленку нерастворимых продуктов, взаимодействуя с первичными анодными продуктами коррозии — ионами растворяющегося металла.
NaOH , Na2CO3 образуют гидроокиси черных металлов, фосфаты, полифосфаты и бензоаты — фосфаты и бензоаты железа, или с первичным катодным продуктом — гидроксильными ионами при кислородной деполяризации:
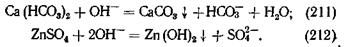
Труднорастворимые соединения образуются в первую очередь на анодных или катодных участках соответственно.Добавление анолныхпленкообразователей в недостаточном количестве может привести к более глубокой местной коррозии вследствие увеличения отношения площади катодных и анодных участков.
Хемосорбционные слои или экранирующие пленки в большинстве случаев тормозят протекание анодного и катодного процессов примерно в равной степени.
Замедляющее действие хемосорбционных соединений может быть в ряде случаев (например, хемосорбция ионов галоидов на стали Х18Н9 в растворах Н2SО4) обусловлено сдвигом потенциала нулевого заряда металла при хемосорбции с соответствующей неблагоприятной для коррозионного процесса перезарядкой его поверхности.
Примером смешанных замедлителей электрохимической коррозии металловявляются вещества, тормозящие протекание обоих электродных процессов (например, катапин), а также применяемые для защиты стали и чугуна от атмосферной коррозии нитриты аминов, которые пассивируют поверхность стали и чугуна образующейся при их гидролизе азотистой кислотой, а освободившийся амин связывает поступающую из воздуха агрессивную по отношению к металлу угольную кислоту, в результате чего образуется карбонат амина.
Раздел 3. МЕТАЛЛИЧЕСКИЕ И НЕОРГАНИЧЕСКИЕ ПОКРЫТИЯ
Дата добавления: 2015-11-04; просмотров: 2403;
