Основы химической термодинамики
Термодинамика - наука, изучающая закономерности процессов, сопровождающихся взаимным превращением различных видов энергии. Объектом исследования в термодинамике являются только макроскопические системы. Термодинамические системы могут быть следующими:
Гомогенная – система, в которой каждое свойство (обычно агрегатное состояние) имеет одно и то же значение во всех точках объема или меняется плавно.
Гетерогенная – система, которая состоит из нескольких гомогенных систем, отделенных друг от друга поверхностью раздела фаз, на которой свойства меняются скачком.
Фаза – гомогенная часть гетерогенной системы, имеющая одинаковые свойства во всех точках всего объема.
Открытая система – обменивается веществом и энергией с окружающей средой.
Закрытая система – не обменивается с окружающей средой веществом, но обменивается энергией.
Адиабатная (изолированная) система – не обменивается ни веществом, ни энергией с окружающей средой.
Мерой движения материи является энергия Е, Дж. Существуют две формы перехода энергии:
1) Путем хаотических столкновений молекул двух соприкасающихся тел, т.е. путем теплопроводности. Мерой передачи Е в таком случае является теплота (Q, Дж).
2) Все виды передачи Е, общей чертой которых является перемещение макроскопических масс под действием каких-либо сил. Мерой передачи таким способом энергии является работа (A, Дж).
Первый закон термодинамики и ЕГО приложение к идеальным газам
Первый закон термодинамики: Вечный двигатель I-го рода невозможен, т.е. невозможно построить такую машину, которая, производя бесконечное число раз один и тот же процесс, приводила бы к накоплению энергии в изолированной системе.
Математическое выражение I-го закона термодинамики:
а) в дифференциальной форме:
dQ =dU + dA,
где d – бесконечно малое количество, d –бесконечно малое изменение.
б) в интегральной форме:
Q = A + DU,
DU = U2–U1–изменение внутренней энергии системы.
Внутренняя энергия U системы является функцией состояния, то есть ее изменение не зависит от пути процесса и определяется только исходным и конечным состоянием системы. Теплота и работа не являются функциями состояния, так как будут зависеть от пути процесса. В термодинамике положительной считается теплота, поглощенная системой, а отрицательной – отданная системой. Работу, совершенную системой против внешних сил, считают положительной, совершенную над системой – отрицательной. Если системой совершается только работа против сил внешнего давления (работа расширения), то ее можно выразить по формуле:
dA = рdV,
где р – давление, dV – бесконечно малое изменение объема, V,
А = рDV.
Идеальным считается газ, где отсутствуют всякие взаимодействия между частицами, которые уподобляются несжимаемым недеформируемым шарикам. Идеальный газ подчиняется:
а) уравнению состояния Менделеева - Клапейрона:
РV = nRT.
б) уравнению Гей-Люссака – Джоуля:
U = f (T)
Изотермический процесс (Т=const)
рV = nRT=const, рV = const или р1V1 = р2V2 – уравнение изотермы, P1 и P2,V1 и V2 – соответственно объем и давление газа до и после протекания процесса.
В этом случае U = f (T) = const, Þ DU = 0, Q = A = рDV,
Q = A = nRT ln(V2/V1) = nRT ln(P1/P2)
Изохорный процесс (V=const)
Уравнение изохоры: 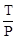 = const или
= const или 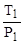 =
= 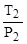
Так как объем системы постоянен, то DV = 0, и элементарная работа расширения равна нулю: A = рDV = 0 Þ Qv = DU.
Qv = DU = nCvDТ,
где Сv – мольная теплоемкость при постоянном объеме. Для одноатомных газов Cv = (3/2)×R »12,47 Дж/(моль×К), для двухатомных и линейных многоатомных газов (например, СО2): Cv = (5/2)×R » 20,78 Дж/(моль×К); для нелинейных многоатомных газов: Cv = 3R=24,93 Дж/(моль×К).
Изобарный процесс (р=const)
Уравнение изобары: 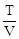 = const или
= const или 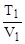 =
= 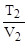
DН = DU + pDV,
Q = DU + A, Q = DU + pDV, где Н – энтальпия газа, являющаяся, как и внутренняя энергия, функцией состояния.
Qр = DН = nCрDТ,
где Ср – мольная теплоемкость газа при постоянном давлении. Для 1 моль идеального газа: Ср – Сv = R
Адиабатный процесс (dQ =0).
Уравнение адиабаты: 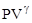 =const, или
=const, или 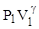 =
= 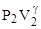 , где g = Ср/Сv.
, где g = Ср/Сv.
Тогда: A = –DU, А = -DU = nCv(Т1-Т2)
При решении задач следует помнить, что все величины должны быть выражены в единицах системы СИ: давление - в Па (1 атм = =1,013×105Па = 760 мм рт. ст.), теплота и работа - в Дж (H×м), объем - в м3 [1м3 = 103 дм3 (л) = 106 см3(мл)], температура - в градусах по шкале Кельвина (00С = 273К).
Нормальными условиями (н.у.) считаются условия, при которых Р = 1 атм = 101325 Па, Т = 273 К; стандартными - Р = 1 атм = 101325 Па, Т = 250С = 298 К.
Термохимия. Закон Гесса
Термохимия – раздел химической термодинамики, изучающий тепловые эффекты различных физико-химических процессов (теплоты химических реакций, фазовых переходов, растворения, испарения и т.д.).
Согласно закону Гесса, тепловой эффект реакции не зависит от пути процесса (промежуточных стадий), а определяется лишь начальным и конечным состоянием системы при условии, что давление или объем в течение всего процесса остаются неизменными, и температуры в начале и в конце процесса одинаковы. Математическая формулировка закона Гесса является непосредственным следствием первого закона термодинамики и выражается уравнениями:
QV = DU
Qр = DН
Взаимосвязь изобарного и изохорного тепловых эффектов описывается уравнением:
DН =DU + DnRT
или
QР= QV + DnRT,
где Dn - изменение числа моль газообразных веществ, принимающих участие в реакции, т.е.:
Dn = Snпрод(газ) - Snисх(газ),
где Snпрод.(газ) – сумма числа моль газообразных продуктов реакции; Snисх.(газ) – сумма числа моль газообразных исходных веществ (по уравнению реакции).
Уравнение справедливо в предположении, что газообразные реагенты и их смесь в газовой фазе подчиняются законам идеальных газов.
В термохимических уравнениях реакций около символов химических соединений указываются агрегатные состояния этих соединений или аллотропная модификация, а в правой части уравнения указываются численные значения тепловых эффектов. Это термохимическая система записи. Более современной является термодинамическая система записи, когда тепловой эффект, равный DН или DU, записывается после уравнения химической реакции. В термодинамике считается положительной теплота, поглощенная системой, а в термохимии, наоборот, выделенная системой. Поэтому теплоты в термодинамической и термохимической системах записи отличаются знаком. В термохимии теплоты обозначаются теми же символами, что и в термодинамике, но с черточкой наверху: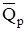 ,
,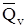 . Следовательно:
. Следовательно:
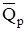 = -QP,
= -QP, 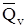 =-QV.
=-QV.
Тепловой эффект реакции может быть определен по закону Гесса методом термохимических схем. На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими (при этом участники реакции должны находиться при одинаковых условиях). Обычно для расчетов используют стандартные условия (Р = 1атм = 1,013×105Па, Т=298 К). Тепловые эффекты при этих условиях обозначают DН0 (значок 0 указывает на стандартные условия).
Задание. Реакция горения углерода С(тв) + О2(г) = СО2(г) протекает с ΔHº = – 393,5 кДж. Какова масса сгоревшего углерода, если при реакции выделилось 163960 кДж теплоты?
n(C) = 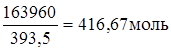
m(C) = n(C)×M(C) =416,67×12 = 5000 г.
Из закона Гесса вытекает несколько следствий, важнейшие из них два:
I следствие.Тепловой эффект реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции, с учетом их стехиометрических коэффициентов:
DНр-ции = Snн DНсгорнач - Snк DНсгоркон
Например, для реакции:
aА + bВ Þ сС + dD
DН0р-и = (aDН0сгор.A+ bDН0сгор.B) - ( сDН0сгор.С+ dDН0сгор.D).
Теплотой сгорания соединения называется тепловой эффект реакции полного сгорания 1 моль данного соединения при стандартных условиях с образованием соответствующих устойчивых продуктов (для органических соединений это обычно СО2 и Н2О).
Задание.Вычислить тепловой эффект реакции:
C2Н5OH (ж) + СН3СООН (ж) = СН3COOC2Н5 (ж) + Н2О (ж)
при 250С, если стандартные теплоты сгорания веществ следующие:
| Дано: DH0сгор.(C2Н5OH(ж)) = -1366,9 кДж/моль, DH0сгор.(СН3СООН(ж)) = -873,8 кДж/моль, DH0сгор.(СН3COOC2Н5(ж)) = -2254,2кДж/моль, DH0сгор.(Н2О(ж)) = 0 кДж/моль. | Решение. C2Н5OH (ж) + СН3СООН (ж) = = СН3COOC2Н5 (ж) + Н2О (ж) Согласно первому следствию из закона Гесса искомый тепловой эффект реакции равен: |
| DH0р-ции - ? |
DH0р-ции = DH0сгор.(C2Н5OH(ж)) + DH0сгор.(СН3СООН (ж)) - DH0сгор.(СН3COOC2Н5(ж)) -
- DH0сгор.(Н2О (ж)) = -1366,9 -873,8 - (-2254,2) – 0 = 13,5 кДж.
II следствие.Тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ, с учетом их стехиометрических коэффициентов:
DНр-ции = SnкDНобркон - SnнDНобрнач
Например, для реакции:
aА + bВ = сС + dD
DН0р-и=(сDН0обр.С+ dDН0обр.D) - (aDН0обр.A+ bDН0обр.B).
Теплотой образования соединения называется тепловой эффект реакции образования 1 моль данного соединения при стандартных условиях из соответствующих простых веществ, взятых в той модификации и в том агрегатном состоянии, которые наиболее устойчивы при данных условиях.
Стандартные теплоты сгорания и образования приведены в специальных таблицах стандартных величин. Стандартные теплоты образования и сгорания простых веществ равны нулю.
Задание. Пользуясь стандартными теплотами образования соединений, вычислить тепловой эффект реакции при 250С:
Fе2O3 (т) + 3СО (г) = 2Fe (т) + 3СО2 (г)
Теплоты образования веществ следующие:
| DH0обр.(Fe2O3(т)) = -821,32 кДж/моль; DH0обр.(СO(г)) = -110,5 кДж/моль; DH0обр.(Fe(т)) = 0 кДж/моль; DH0обр.(СO2 (г)) = -393,51 кДж/моль. | Решение. Fе2O3 (т) + 3СО (г) = 2Fe (т) + 3СО2 (г) Согласно второму следствию из закона Гесса, искомый тепловой эффект реакции равен: |
| DH0р-ции - ? |
DH0р-ции = 2DH0обр.(Fe(т)) + 3DH0обр.(СO2(г)) -DH0обр.(Fe2O3(т)) - 3DH0обр.(СO(г)) = -3×393,51 + 821,32 + 3×110,5 = -27,71 кДж.
Дата добавления: 2015-10-21; просмотров: 1759;
