Третий закон термодинамики
Все вышеприведенные формулы позволяют определить изменение энтропии DS. Абсолютное значение энтропии S вещества можно вычислить, используя постулат Планка, согласно которому энтропия правильно построенного кристалла индивидуального вещества равна нулю при температуре абсолютного нуля (0 К). Этот постулат считается третьим законом термодинамики.
Термодинамические потенциалы.
Функции состояния, изменение которых можно выразить через работу, которые называются термодинамическими потенциалами. Рассмотрим основные из них.
1. Изохорно-изотермический потенциал (свободная энергия Гельмгольца F). Изменение энергии Гельмгольца.
DF = DU – TDS
DF = –DА
DF < 0, самопроизвольный процесс возможен.
2. Изобарно-изотермический потенциал (свободная энергия Гиббса G). Изменение энергии Гиббса:
DG = DU + pDV – TDS
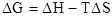
DG = –DА
DG < 0, самопроизвольный процесс возможен.
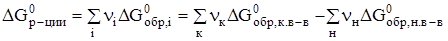
Задание. Возможен ли термодинамический процесс получения анилина из хлорбензола и аммиака по уравнению
С6H5Cl(ж) + NH3(г) ⇆ С6H5NH2(ж) + HCl(г),
если известны стандартные изменения изобарного потенциала образования веществ, входящих в данную реакцию:
DG0(С6H5Cl) = 198,4 кДж/моль;
DG0(NH3) = –16,63 кДж/моль;
DG0(С6H5NH2) = 153,1 кДж/моль;
DG0(HCl) = –95,28 кДж/моль.
Вычисляем стандартное изменение изобарного потенциала реакции
DG 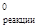 =153,1 –95,28+16,63–198,4= –123,95 кДж.
=153,1 –95,28+16,63–198,4= –123,95 кДж.
Следовательно, процесс возможен.
Изменение энергии Гиббса химической реакции можно рассчитать с использованием значений стандартных энтальпий и энтропий:
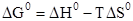 , где
, где 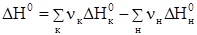 и
и 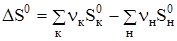 .
.
Задание.Чему равно значение ΔGº при 25ºC (298 К) для реакции:
NiO(тв) + Pb(тв) = Ni(тв) + PbO(тв); ΔHº = 20,4 кДж/моль, если Sº(NiO)=38 Дж/моль•К, Sº(PbO)=66,1 Дж/моль•К?
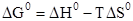 = 12,03 кДж/моль.
= 12,03 кДж/моль.
Дата добавления: 2015-10-21; просмотров: 1695;
