Обучающие задачи. Задача 1.Биологические жидкости имеют следующие значения рН: слюна 6,8; желудочный сок 1,5; кровь 7,4
Задача 1.Биологические жидкости имеют следующие значения рН: слюна 6,8; желудочный сок 1,5; кровь 7,4. Рассчитайте концентрацию ионов водорода в каждой из указанных жидкостей.
Решение: рН= - lg [H+] , lg [H+] = - pH
а) слюна рН = 6,8 , отсюда lg [H+] = -6,8
[H+]=10-6,8=1,59∙´10 -7 моль/л
б) желудочный сок рН = 1,5
рН= - lg [H+] , lg [H+] = - pH, отсюда lg [H+] = - 1,5
[H+]=10-1,5=3,16∙´10 -2 моль/л
в) кровь рН = 7,4
рН= - lg [H+] , lg [H+] = - pH
отсюда lg [H+] = -7,4
[H+]=10-7,4 = 4,0´10 -8 моль/л
Ответ: слюна [H+] = 1,59∙´10-7моль/л, желудочный сок [H+] = 3,16´10-2 моль/л, кровь [H+] = 4´10 -8 моль/л.
Задача 2. Вычислите степень диссоциации уксусной кислоты в растворе с молярной концентрацией эквивалента 0,001 моль/л. Ка (СН3СООН) = 1,8´10-5. Найти концентрацию ионов водорода и рН данного раствора.
Решение:
рН = 1/2 [pKa - lgC(CH3COOH)]; pH = 1/2 [4,75 - lg 0,001] = 1/2∙´ 7,75 = 3,875
[H+] = 10-pH = 10-3,875 = 1,35 ×10 -4;
[H+] = 1,35´10-4 моль/л.
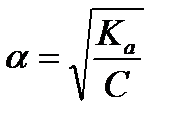 или
или  или 13,5%
или 13,5%
Ответ: [H+] = 1,35 ´10-4 моль/л, рН = 3,875, α = 13,5%.
Задача 3. В клинических и биохимических лабораториях применяется ацетатный буфер, который содержит уксусную кислоту 12 г/л и ацетат натрия 16,4 г/л. Определите концентрацию в моль/л уксусной кислоты и ацетата натрия, рН буферного раствора, зону буферного действия. (Ка (СН3СООН) = 1,8 ´10-5).
Решение:

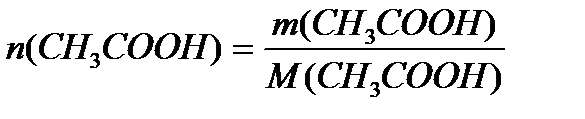
M (CH3COOH) = 12+3+12+32+1 = 60 г/моль
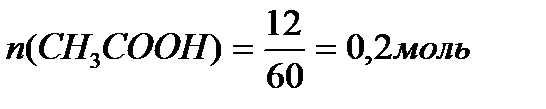
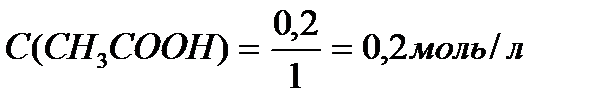

M (CH3COONa) = 12+3+12+32+23 = 82 г/моль.
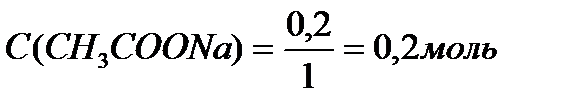
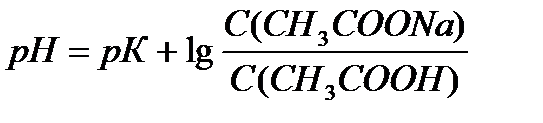
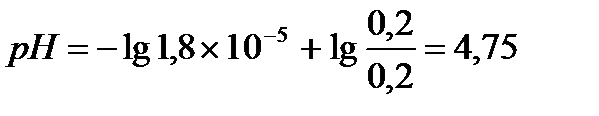
Ответ: С(CH3COOH)=0,2 моль/л, С(CH3COONa) =0,2 моль/л, pH = 4,75, зона буферного действия 4,75 ±1
Задача 4.Напишите уравнения гидролиза: CuCl2, Na2SO3, Cr2S3, NaCl, тристеарид, глицил-глицин, этилэтаноат, АТФ.
Решение:
CuCl2 – растворимая в воде соль, образована катионом слабого основания и анионом сильной кислоты, подвергается гидролизу. Гидролиз протекает по катиону слабого основания, рН<7.
При обычных условиях гидролиз протекает преимущественно по I ступени.
CuCl2 = Cu2+ + 2Cl-
Cu2+ +HOH ↔ CuOH+ + H+
CuCl2 + HOH ↔ CuOHCl + HCl
Na2SO3 – растворимая в воде соль, образована катионом сильного основания и анионом слабой кислоты, подвергается гидролизу. Гидролиз протекает по аниону слабой кислоты, рН>7.
Na2SO3 = 2Na+ + SO32-
SO32- + HOH ↔ HSO3- + OH-
Na2SO3 + HOH ↔ NaHSO3 + NaOH
Cr2S3– соль, образованная слабым нерастворимым в воде основанием и слабой летучей кислотой. В водном растворе соль не существует, так как подвергается полному гидролизу:
Cr2S3 + 6HOH = 2Cr(OH)3↓ + 3H2S↑
NaCl– растворимая в воде соль, образована катионом сильного основания и анионом сильной кислоты. Гидролизу не подвергается.
Тристеарид – это жир, образованный многоатомным спиртом глицерином и стеариновой кислотой, эти вещества и получаются при гидролизе:
CH2-O-CO-C17H35 CH2-OH
| |
CH-O-CO-C17H35 + 3H2O ↔ CH-OH + 3C17H35COOH
| |
CH2-O-CO-C17H35 CH2-OH
Глицилглицин– дипептид, при его гидролизе происходит разрыв пептидной связи
NH2-CH2-CO-NH-CH2-COOH + H2O ↔ NH2-CH2-COOH + NH2-CH2-COOH
Этилэтаноат – сложный эфир, при гидролизе которого образуются спирт и карбоновая кислота.
СH3COOC2H5 + HOH ↔ CH3COOH + C2H5OH
Аденозинтрифосфат (АТФ) – главный источник энергии для многих биологических процессов – биосинтеза белка, ионного транспорта, сокращения мышц, электрической активности нервных клеток. Гидролиз АТФ записывают в виде кислотно-основного равновесия:
АТФ4- + HOH ↔ АДФ3- + HPO42- + H+, ∆G0=-30,5кДж/моль
Задача 5.Определить рН раствора, константу и степень гидролиза ацетата калия, если молярная концентрация соли равна 0,1 моль/л, а Kа(СН3СООН)=1,8×10-5.
Решение:Уравнение гидролиза
СН3СООК + НОН ↔ СН3СООН + КОН
СН3СОО- + НОН ↔ СН3СООН + ОН-
Вычислим константу гидролиза
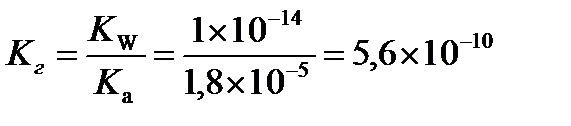
Рассчитаем степень гидролиза
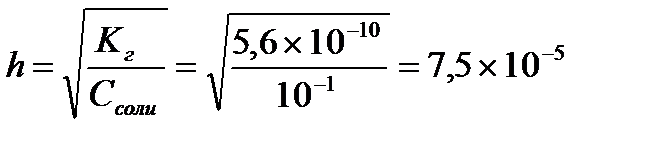
Определяем концентрацию гидроксид-ионов в растворе и рОН
С(ОН-)= h×Cсоли = 7,5×10-5×0,1 = 7,5×10-6 (моль/л)
рOН = -lg[OH-] = -lg7,5×10-6 = 5,12
pH = 14 – pOH = 14 – 5,12 = 8,88
Ответ:рН = 8,88, Кг = 5,6×10-10, h = 7,5×10-5
Дата добавления: 2015-10-19; просмотров: 6416;
