В общем виде для реакции

выражение для константы равновесия должно быть записано:
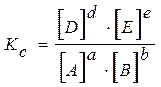 .
.
Концентрации реагентов при установившемся равновесии называются равновесными концентрациями.
В случае гетерогенных обратимых реакций в выражение Кс входят только равновесные концентрации газообразных и растворенных веществ. Так, для реакции СаСО3 ↔ СаО + СО2
Кс=[СО2].
При неизменных внешних условиях положение равновесия сохраняется сколь угодно долго. При измении внешних условий положение равновесия может измениться. Изменение температуры, концентрации реагентов (давления для газообразных веществ) приводит к нарушению равенств скоростей прямой и обратной реакций и, соответственно, к нарушению равновесия. Через некоторое время равенство скоростей восстановится. Но равновесные концентрации реагентов в новых условиях будут уже другими. Переход системы из одного равновесного состояния к другому называется смещением или сдвигом равновесия. Химическое равновесие можно сравнить с положением коромысла весов. Подобно тому, как оно изменяется от давления груза на одну из чашек, химическое равновесие может смещаться в сторону прямой или обратной реакции в зависимости от условий процесса. Каждый раз при этом устанавливается новое равновесие, соответствующее новым условиям.
Численное значение константы обычно изменяется с изменением температуры. При постоянной температуре значения Кс не зависят ни от давления, ни от объема, ни от концентраций веществ.
Зная численное значение Кс, можно вычислить значения равновесных концентраций или давлений каждого из участников реакции.
Например, допустим, что необходимо вычислить равновесную концентрацию HI, получающуюся в результате реакции Н2 + I2 ↔ 2HI. Обозначим исходные концентрации Н2 и I2 через С, а их изменение к моменту равновесия через х (моль/л). Тогда равновесные концентрации реагентов составляют:
[I2] = (C – x); [H2] = (C – x) = [I2]; [HI] = 2x.
Имеем 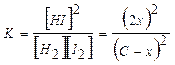 . Исходя из этого выражения, можно рассчитать х и, значит, равновесные концентрации реагентов.
. Исходя из этого выражения, можно рассчитать х и, значит, равновесные концентрации реагентов.
Для реакций с участием газов удобнее пользоваться парциальными давлениями веществ. Константу равновесия в этом случае обозначают через Кр.
Существует связь между Кс и Кр. На примере реакции синтеза аммиака найдем ее.
N3+ 3H2 ↔ 2NH3;
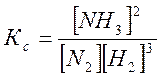 .
.
Концентрации веществ в газовой среде можно выразить как отношение числа молей n вещества к объему системы V:
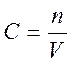 .
.
Значение n можно найти из уравнения Менделеева – Клапейрона:
РV = nRT => n =  .
.
Получаем 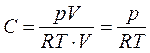 .
.
Выражаем через полученное значение величину Кс:
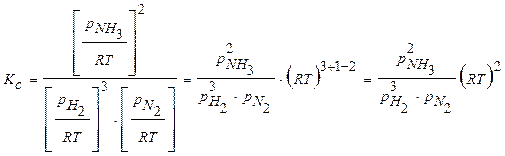 .
.
Или можно записать другим образом:
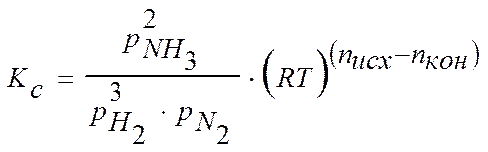
После незначительных преобразований получим:
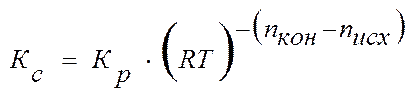
или
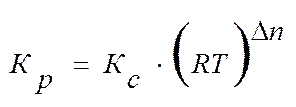 ,
,
где 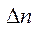 - разность коэффициентов в уравнении реакции
- разность коэффициентов в уравнении реакции
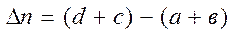 .
.
Для реакций, протекающих без изменения объема получаем:
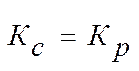 .
.
Существует связь между изменением изобарно–изотермического потенциала химической реакции и константой равновесия, выраженной через парциальное давление компонентов А, В, С, D, Е при равновесии.
Для температуры 298 она выглядит следующим образом:
 .
.
Если 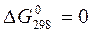 , то
, то 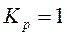 ; если
; если 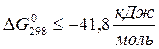 , то
, то 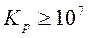 и прямая реакция практически необратима в стандартных условиях: если
и прямая реакция практически необратима в стандартных условиях: если 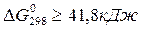 , то
, то 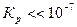 и обратная реакция практически необратимая.
и обратная реакция практически необратимая.
Направление смещения положения химического равновесия в результате изменения внешних условий определяется принципом Ле Шателье:
Дата добавления: 2015-10-19; просмотров: 867;
