Влияние температуры на состояние равновесия
2Н2 + О2 <=> 2Н2О(г) + 484,9 кДж.
Процесс образования воды является экзотермическим, разложение – эндотермическим.
В соответствии с принципом Ле Шателье при подведении теплоты к этой равновесной системе равновесие должно смещаться в сторону эндотермической реакции, то есть должно приводить к разложению воды. В результате этого произойдет уменьшение равновесной концентрации водяного пара и увеличение равновесных концентраций водорода и кислорода.
Охлаждение этой системы приведет к усилению экзотермического процесса.
Рассмотрим систему:
N2 + 3H2 <=> 2NH3 + 92кДж.
Понижение температуры смещает равновесие вправо, то есть увеличивает выход NH3. Однако в промышленности этот процесс ведется при довольно высоких температурах. Это вызвано тем, что при низких температурах скорость установления равновесия мала, хотя выход целевого продукта выше.
Таким образом, при нагревании равновесной системы равновесие смещается в сторону эндотермической реакции, при охлаждении – в сторону экзотермической реакции.
Влияние катализаторов на состояние равновесия
Введение катализаторов в равновесную систему не вызывает смещения равновесия, поскольку катализатор, ускоряя прямую реакцию, в такой же мере ускоряет и обратную реакцию. Но введение катализаторов позволяет добиваться наступления равновесия в более короткие сроки.
Литература
1. Глинка Н.Л. Общая химия. – М.: Химия, 1978. – С. 166-191.
2. Шиманович И.Е., Павлович М.Л., Тикавый В.Ф., Малашко П.М. Общая химия в формулах определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 102-115.
3. Карапетьянц М.Х. Введение в теорию химических процессов. – М.: Высшая школа, 1981. – С. 75-90.
4. Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 39-46.
Тема 4. Водные растворы электролитов
Рассматриваемые вопросы:
1. Электролитическая диссоциация и причины ее возникновения.
2. Сильные и слабые электролиты.
3. Гидролиз солей.
Электролитами называются вещества, которые в расплавленном или растворенном состоянии проводят электрический ток.
Теорию электролитической диссоциации разработал Сванте Аррениус. Предложенная им теория объяснила поведение и многие свойства электролитов.
Согласно этой теории молекулы электролита в воде или другой среде, характеризующейся большой диэлектрической проницаемостью*, распадаются на ионы – положительные (катионы) и отрицательные (анионы).
Процесс распада вещества на ионы получил название электролитической диссоциации. Для слабых электролитов она протекает обратимо и выражается следующим примерным уравнением
КА <=> К++А-.
К электролитам относятся вещества, в молекулах которых атомы связаны сильно полярной или ионной химической связью.
По современным представлениям электролитическая диссоциация в растворе происходит в результате сложного физико–химического взаимодействия молекул электролита с полярными молекулами растворителя.
Взаимодействие ионов с полярными молекулами растворителя называется сольватацией (для водных растворов - гидратацией) ионов. Сольватация приводит к образованию в растворе ассоциаций между ионами (катионами и анионами) и молекулами растворителя. Процесс растворения вещества К+А- в воде, являющегося соединением с типичной ионной связью, может быть записан следующим образом:
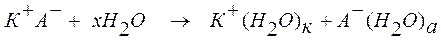 .
.
твердое жидкий раствор
вещество растворитель
Электролитическая диссоциация полярных молекул (КА) в растворе происходит вследствие ослабления связи, вызванного действием полярных молекул растворителя:
КА + хН2О <=> К+(Н2О)к + А-(Н2О)а.
Ассоциации К+(Н2О)к и А-(Н2О)а представляют собой гидратированные катионы и анионы.
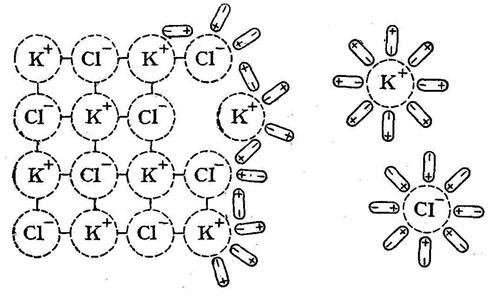
Немаловажное значение имеет величина диэлектрической проницаемости растворителя: чем больше последняя, тем больше ослабляются связи между ионами электролита. Это вытекает из формулы закона Кулона 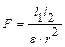 , где F – сила взаимодействия между зарядами l1 и l2, r расстояние между центрами ионов, ε – диэлектрическая проницаемость растворителя. Для воды при 20° ε = 80, то есть сила притяжения ионов в водном растворе ослабляется в 80 раз.
, где F – сила взаимодействия между зарядами l1 и l2, r расстояние между центрами ионов, ε – диэлектрическая проницаемость растворителя. Для воды при 20° ε = 80, то есть сила притяжения ионов в водном растворе ослабляется в 80 раз.
Если в растворе дополнительно могут возникнуть еще и водородные связи между молекулами растворителя и атомом водорода растворенного вещества, то процесс диссоциации протекает еще более эффективно.
С точки зрения теории электролитической диссоциации кислотой называется соединение, диссоциирующее в водном растворе с образованием гидратированных водородных ионов (гидроксоний-ионов) и кислотного остатка:
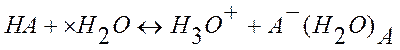 ,
,
где Н3О+ - ион гидроксония.
Все общие свойства кислот (кислый вкус, способность изменять окраску индикаторов и т.д.) принадлежат иону гидроксония.
Основанием называется соединение, диссоциирующее в водном растворе с образованием отрицательных гидроксид–ионов ОН-:
МеОН + хН2О <=> Ме+(Н2О)к + ОН- + (х-к)Н2О,
где Ме+ - одновалентный катион.
Все общие свойства растворимых оснований (щелочно–мыльный вкус, способность определенным образом изменять окраску индикаторов и т.д.) принадлежат гидроксид–иону.
С точки зрения электролитической диссоциации соли можно рассматривать как продукт взаимодействия кислоты и основания:
х(кислота) + у(основание) → соль + вода,
где х и у – переменное количество эквивалентов взаимодействующих между собой кислот и оснований.
В зависимости от соотношения х и у различают следующие виды солей, диссоциирующих в водных растворах по схеме:
при х > у – кислые соли
2H2SO4 + Mg(OH)2 ® Mg(HSO4)2 + 2H2O;
Mg(HSO4)2 <=> Mg2+ + 2HSO4- ;
при х = у – средние (нормальные) соли
H2SO4 + Mg(OH)2 ® MgSO4 + 2H2O;
MgSO4 <=> Mg2+ + SO42-;
при х < у – основные соли
H2SO4 + 2Mg(OH)2 ® (MgOH)2SO4 + 2H2O;
(MgOH)2SO4 <=> 2MgOH+ + SO42-;
Как правило, все соли относятся к сильным электролитам.
Сильные электролиты в водных растворах полностью диссоциированы на ионы.
В воде, являющейся растворителем, статистически равномерно распределяются полностью гидратированные катионы и анионы сильного электролита. Электростатическое взаимодействие между ионами ослабляется до минимума большими расстояниями между ними и гидратными оболочками, выполняющими экранирующую роль.
В отличие от сильных электролитов диссоциация слабых электролитов протекает обратимо и устанавливается равновесие.
Количественно процесс диссоциации может быть охарактеризован рядом величин: степенью электролитической диссоциации a, константой электролитической диссоциации К и др.
Степень электролитической диссоциации a – это отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе.
a может измеряться в долях единицы или в процентах. a = 0, если диссоциация отсутствует; a = 1 или a = 100 % при полной диссоциации электролита.
К процессу электролитической диссоциации, как к обратимому процессу, можно применять принцип Ле Шателье и выявить влияние внешних факторов на состояние равновесия, приводящее к изменению значения a.
Для смещения равновесия
К+А- + хН2О <=> К+(Н2О)к + А-(Н2О)а
слева направо, то есть в сторону диссоциации, необходимо увеличить массу растворителя. Это означает, что:
1. диссоциация слабых электролитов проходит эффективнее в разбавленных растворах, чем в концентрированных. Иными словами, a возрастает с уменьшением концентрации электролита в растворе и принимает максимальное значение a = 1 в бесконечно разбавленном растворе.
2. так как процесс диссоциации является эндотермическим, то степень диссоциации слабого электролита в водных растворах будет увеличиваться с повышением температуры.
Константой электролитической диссоциации К называется постоянная химического равновесия в растворе электролита:
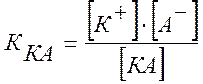 ,
,
где [К+], [A-] и [KA] - концентрации в растворе ионов 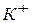 и
и 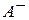 (в г-ион/л) и недиссоциированного соединения КА (в моль/л).
(в г-ион/л) и недиссоциированного соединения КА (в моль/л).
Чем больше К, тем электролит лучше распадается на ионы. Для данного электролита значение К постоянно при определенной температуре и в отличие от a не зависит от концентрации.
Связь между константой К и степенью диссоциации a может быть найдена следующим образом. Концентрация ионов К+ и А- в растворе равна
[К+] = [А-] = aС,
где С – исходная молярная концентрация; a – степень электролитической диссоциации электролита. Концентрация недиссоциировавших молекул КА в растворе равна
[КА]=(1- a)С.
Откуда 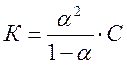 .
.
Данное уравнение выражает закон разбавления Оствальда.
Если a мала, то 1- a ≈ 1 и тогда
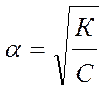 .
.
Видно, что с уменьшением концентрации электролита в растворе степень электролитической диссоциации возрастает.
Диссоциация слабого электролита, молекула которого может диссоциировать не на два, а на большее количество ионов (электролиты с разновалентными ионами), протекает по стадиям (ступенчатая диссоциация). Например, при диссоциации слабой угольной кислоты Н2СО3 в водном растворе имеют место следующие равновесия:
I стадия: Н2СО3 <=> Н+ + НСО3-
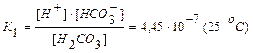 .
.
II стадия: НСО3- <=> Н+ + СО32-
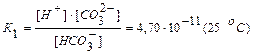 .
.
Как видно из этих данных, процесс диссоциации слабого электролита с разновалентными ионами определяется главным образом первой ступенью.
Для примера приведем константы электролитической диссоциации некоторых слабых кислот и оснований (25 °С):
| СН3СООН | <=> | H+ + CH3COO- | 1,76·10-5 |
| NH4OH | <=> | NH4+ + OH- | 1,79·10-5 |
| HNO2 | <=> | H+ + NO2- (18 °C) | 4·10-4 |
| H2S | <=> | H+ + HS- | 6·10-8 |
| H3PO4 | <=> | H+ + H2PO4- | 7,52·10-3 |
| HF | <=> | H+ + F- | 6,61·10-4 |
| HCN | <=> | H++CN- | 7,9·10-10 |
Дата добавления: 2015-10-19; просмотров: 1186;
