Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в системе усиливаются те процессы, которые стремятся свести это воздействие к минимуму.
Влияние концентраций реагирующих веществ на состояние
равновесия
При контактном способе получения Н2SO4 окисление SO2 в SO3 в присутствии катализатора (Pt или V2O5) идет по уравнению:
 .
.
Если в эту равновесную систему добавить извне О2, то в системе усиливается процесс, стремящийся понизить концентрацию О2. Таким процессом является прямая реакция SO2 с О2 с образованием SO3. Таким образом, равновесие в системе сместится в сторону образования SO3. К этому же выводу можно прийти при анализе выражения для константы равновесия:
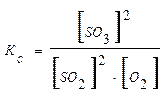 .
.
При увеличении концентрации О2 (знаменатель в этом выражении) должна возрасти концентрация SO3 (числитель). Это следует из того, что Кс=const. Таким образом, повышение концентрации O2 сдвинет равновесие к более полному использованию SO2 и к большему выходу SO3.
Влияние давления на состояние равновесия
Давление имеет существенное значение при реакциях между газами.
В результате увеличения давления повышается концентрация реагирующих веществ и, соответственно, скорость реакции.
Рассмотрим возможные случаи.
А). В реакции сумма молей исходных веществ равна сумме молей продуктов реакции. Суммарные соответствующие объемы газов тоже будут равными.
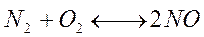 .
.
Если увеличить давление в закрытом реакционном сосуде, например, в 2 раза, то объем изменится тоже вдвое. Соответственно, вдвое изменится и концентрация газов. Скорость прямой и обратной реакций возрастает, но в равное количество раз. Поэтому смещения химического равновесия при этом не происходит.
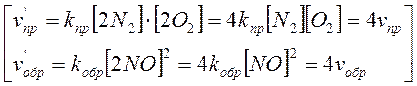 .
.
Таким образом, если объемы исходных и конечных газообразных продуктов равновесной системы равны между собой, то изменение давления не нарушает равновесия.
Б). Сумма молей исходных веществ больше суммы молей образующихся продуктов:
N2 + 3H2 Û 2NH3.
Из четырех молей исходных веществ образуется два моля продуктов - реакция протекает с уменьшением объема. [При повышении давления концентрация исходных веществ будет увеличиваться в большей степени, чем концентрация продуктов, что приводит к смещению равновесия в сторону образования аммиака.]
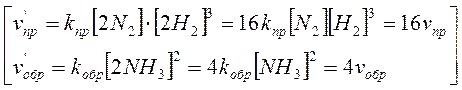 .
.
В). Сумма молей исходных веществ меньше суммы молей продуктов:
N2O4 <=> 2NO2;
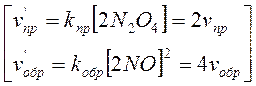 .
.
Прямая реакция ведет к увеличению числа молей вещества в системе, то есть к увеличению давления.
При протекании обратной реакции, наоборот давление в системе падает. Если при установившемся равновесии повысить давление, то система окажет противодействие, стремясь к начальному состоянию. Равновесие будет смещаться в сторону обратной реакции, сопровождающейся понижением давления, то есть в сторону образования N2O4. Если давление снизить, то равновесие сместится в сторону прямой реакции, сопровождающейся повышением давления, то есть в сторону образования NO2.
Выводы:
· при изменении давления равновесие смещается только в тех обратимых реакциях, которые сопровождаются изменением объемов газообразных веществ;
· повышение давления сдвигает равновесие в сторону меньших объемов, понижение – в сторону больших объемов.
Дата добавления: 2015-10-19; просмотров: 1001;
