В стандартных условиях энтропия простого вещества не равна нулю.
III закон термодинамики: энтропия чистых веществ, существующих в виде идеальных кристаллов при температуре 0 К, равна нулю.
Стремление системы к возрастанию энтропии называют энтропийным фактором. Этот фактор тем больше, чем выше температура. Количественно энтропийный фактор оценивается произведением Т· 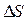 .
.
Стремление системы к понижению потенциальной энергии называют энтальпийным фактором. Количественно эта тенденция системы выражается через тепловой эффект процесса, то есть значением 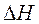 .
.
Самопроизвольно, то есть без затраты работы извне, система может переходить из менее устойчивого состояния в более устойчивое.
В химических процессах одновременно действуют две тенденции: стремление частиц объединиться за счет прочных связей в более сложные, что уменьшает энтальпию системы, и стремление частиц разъединяться, что увеличивает энтропию. Иными словами, проявляется действие двух прямо противоположных факторов – энтальпийного ( 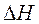 ) и энтропийного (Т·
) и энтропийного (Т· 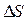 ). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса DG (или изобарно–изотермического потенциала):
). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса DG (или изобарно–изотермического потенциала):
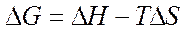 .
.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности являются неравенство:
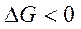 (условие самопроизвольности).
(условие самопроизвольности).
Иными словами, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше, чем в конечном.
Увеличение энергии Гиббса ( 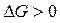 ) свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
) свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
Дата добавления: 2015-10-19; просмотров: 1948;
