Лекция 10. Атомная физика
План лекции
- Эффект Комптона.
- Линейчатые спектры атомов. Постулаты Бора. Принцип соответствия
Тезисы
Наиболее полно корпускулярные свойства света проявляются в эффекте Комптона. Опыты показали, что разность Dl=l'-l не зависит от длины волны l падающего излучения и природы рассеивающего вещества, а определяется только величиной угла рассеяния q: Dl =l'-l= 2lCsin2(q/2), где l' — длина волны рассеянного излучения, lC — комптоновская длина волны (при рассеянии фотона на электроне lC= 2,426 пм).
Эффектом Комптонаназывается упругое рассеяние коротковолнового электромагнитного излучения (рентгеновского и g-излучений) на свободных (или слабосвязанных) электронах вещества, сопровождающееся увеличением длины волны. Этот эффект не укладывается в рамки волновой теории, согласно которой длина волны при рассеянии изменяться не должна: под действием периодического поля световой волны электрон колеблется с частотой поля и поэтому излучает рассеянные волны той же частоты.
Объяснение эффекта Комптона дано на основе квантовых представлений о природе света. Если считать, как это делает квантовая теория, что излучение имеет корпускулярную природу, т. е. представляет собой поток фотонов, то эффект Комптона — результат упругого столкновения рентгеновских фотонов со свободными электронами вещества (для легких атомов электроны слабо связаны с ядрами атомов, поэтому их можно считать свободными). В процессе этого столкновения фотон передает электрону часть своих энергии и импульса в соответствии с законами их сохранения.
Наличие в составе рассеянного излучения «несмещенной» линии (излучения первоначальной длины волны) можно объяснить следующим образом. При рассмотрении механизма рассеяния предполагалось, что фотон соударяется лишь со свободным электроном. Однако если электрон сильно связан с атомом, как это имеет место для внутренних электронов (особенно в тяжелых атомах), то фотон обменивается энергией и импульсом с атомом в целом. Так как масса атома по сравнению с массой электрона очень велика, то атому передается лишь ничтожная часть энергии фотона. Поэтому в данном случае длина волны l' рассеянного излучения практически не будет отличаться от длины волны l падающего излучения.
Из приведенных рассуждений следует также, что эффект Комптона не может наблюдаться в видимой области спектра, поскольку энергия фотона видимого света сравнима с энергией связи электрона с атомом, при этом даже внешний электрон нельзя считать свободным.
Эффект Комптона наблюдается не только на электронах, но и на других заряженных частицах, например протонах, однако из-за большой массы протона его отдача «просматривается» лишь при рассеянии фотонов очень высоких энергий.
Как эффект Комптона, так и фотоэффект на основе квантовых представлений обусловлены взаимодействием фотонов с электронами. В первом случае фотон рассеивается, во втором — поглощается. Рассеяние происходит при взаимодействии фотона со свободным электроном, а фотоэффект — со связанными электронами. Можно показать, что при столкновении фотона со свободным электроном не может произойти поглощения фотона, так как это находится в противоречии с законами сохранения импульса и энергии. Поэтому при взаимодействии фотонов со свободными электронами может наблюдаться только их рассеяние, т. е. эффект Комптона.
2.Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж. Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10-10 м, внутри которого около своих положений равновесия колеблются электроны; суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно.
В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда по рассеянию a-частиц в веществе. Альфа-частицы возникают при радиоактивных превращениях; они являются положительно заряженными частицами с зарядом 2е и массой, примерно в 7300 раз большей массы электрона. Пучки a-частиц обладают высокой монохроматичностью. Резерфорд, исследуя прохождение a-частиц в веществе (через золотую фольгу толщиной примерно 1 мкм), показал, что основная их часть испытывает незначительные отклонения, но некоторые a-частицы (примерно одна из 20 000) резко отклоняются от первоначального направления. Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц, как a-частицы, то Резерфордом был сделан вывод, что значительное отклонение a-частиц обусловлено их взаимодействием с положительным зарядом большой массы. Однако значительное отклонение испытывают лишь немногие a-частицы; следовательно, лишь некоторые из них проходят вблизи данного положительного заряда. Это, в свою очередь, означает, что положительный заряд атома сосредоточен в объеме, очень малом по сравнению с объемом атома.
На основании своих исследований Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома.Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z — порядковый номер элемента в системе Менделеева, е — .элементарный заряд), размер 10-15— 10-14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов.
Для простоты предположим, что электрон движется вокруг ядра по круговой орбите радиуса r. При этом кулоновская сила взаимодействия между ядром и электроном сообщает электрону центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид
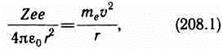
где те и v — масса и скорость электрона на орбите радиуса r, e0 — электрическая постоянная.
Уравнение (208.1) содержит два неизвестных: r и v. Следовательно, существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (а значит, и энергии), удовлетворяющих этому уравнению. Поэтому величины r, v (следовательно, и Е) могут меняться непрерывно, т. е. может испускаться любая, а не вполне определенная порция энергии. Тогда спектры атомов должны быть сплошными. В действительности же опыт показывает, что атомы имеют линейчатый спектр. Из выражения (208.1) следует, что при r»10-10 м скорость движения электронов v»106 м/с, а ускорение v2/r=1022м/с2. Согласно электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Таким образом, атом Резерфорда оказывается неустойчивой системой, что опять-таки противоречит действительности.
Попытки построить модель атома в рамках классической физики не привели к успеху: модель Томсона была опровергнута опытами Резерфорда, ядерная же модель оказалась неустойчивой электродинамически и противоречила опытным данным. Преодоление возникших трудностей потребовало создания качественно новой — квантовой — теории атома.
Первая попытка построить качественно новую — квантовую — теорию атома была предпринята в 1913 г. датским физиком Нильсом Бором. Он поставил перед собой цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил два постулата.
Первый постулат Бора (постулат стационарных состояний):в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
mevrn = nh (n=1, 2, 3, ...), (210.1)
где me — масса электрона, v — его скорость по n-й орбите радиуса rn, h=h/(2p).
Второй постулат Бора (правило частот):при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
hn=En-Em, (210.2)
равной разности энергий соответствующих стационарных состояний (En и Em — соответственно энергии стационарных состояний атома до и после излучения (поглощения)). При Em<En происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т. е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Em>En — его поглощение (переход атома в состояние с большей энергией, т. е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот v = = (En-Em)/h квантовых переходов и определяет линейчатый спектр атома.
Теория Бора была крупным шагом в развитии атомной физики и явилась важным этапом в создании квантовой механики. Однако эта теория обладает внутренними противоречиями (с одной стороны, применяет законы классической физики, а с другой — основывается на квантовых постулатах). Она рассмотрела спектры атома водорода и водородоподобных систем и вычислила частоты спектральных линий, однако не смогла объяснить их интенсивности и ответить на вопрос: почему совершаются те или иные переходы? Серьезным недостатком теории Бора была невозможность описания с ее помощью спектра атома гелия — одного из простейших атомов, непосредственно следующего за атомом водорода.
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем— систем, состоящих из ядра с зарядом Ze и одного электрона (например, ионы Не+, Li2+), а также теоретически вычислить постоянную Ридберга.
Следуя Бору, рассмотрим движение электрона в водородоподобной системе, ограничиваясь круговыми стационарными орбитами. Решая совместно уравнение (208.1) mev2/r=Zе2/(4pe0r2), предложенное Резерфордом, и уравнение (210.1), получим выражение для радиуса n-й стационарной орбиты:
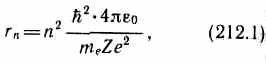
где n=1, 2, 3, ... . Из выражения (212.1) следует, что радиусы орбит растут пропорционально квадратам целых чисел.
Для атома водорода (Z=1) радиус первой орбиты электрона при n=1, называемый первым боровским радиусом(а), равен 52,8 пм, что соответствует расчетам на основании кинетической теории газов. Так как радиусы стационарных орбит измерить невозможно, то для проверки теории необходимо обратиться к таким величинам, которые могут быть измерены экспериментально. Такой величиной является энергия, излучаемая и поглощаемая атомами водорода. Энергия электрона может принимать только следующие дозволенные дискретные значения:
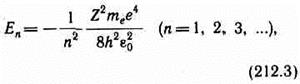
где знак минус означает, что электрон находится в связанном состоянии.
Из формулы следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения п. Целое число n, определяющее энергетические уровни атома, называется главным квантовым числом.Энергетическое состояние с n=1 является основным (нормальным)состоянием; состояния с/г>1 являются возбужденными.Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным)уровнем; все остальные уровни являются возбужденными.
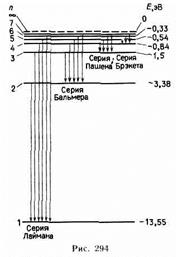
Придавая n различные целочисленные значения, получим для атома водорода (Z=1) возможные уровни энергии, схематически представленные на рис. 294. Энергия атома водорода с увеличением n возрастает (уменьшается ее отрицательная величина) и энергетические уровни сближаются к границе, соответствующей значению n=¥. Атом водорода обладает, таким образом, минимальной энергией (Е1=-13,55 эВ) при n=1и максимальной (E1=0) при n=¥ (при удалении электрона из атома). Следовательно, значение E¥=0 соответствуетионизацииатома (отрыву от него электрона).
Согласно второму постулату Бора, при переходе атома водорода (Z=1) из стационарного состояния n с большей энергией в стационарное состояние m с меньшей энергией испускается квант
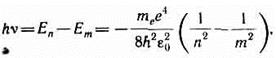
откуда частота излучения
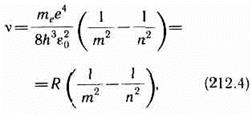
где R=mee4/(8h3e20).
Воспользовавшись при вычислении R современными значениями универсальных постоянных, получим величину, совпадающую с экспериментальным значением постоянной Ридберга в эмпирических формулах для атома водорода. Это совпадение убедительно доказывает правильность полученной Бором формулы для энергетических уровней водородоподобной системы.
Спектр поглощения атома водорода является линейчатым, но содержит только серию Лаймана. Он также объясняется теорией Бора. Так как свободные атомы водорода обычно находятся в основном состоянии (стационарное состояние с наименьшей энергией при n=1), то при сообщении атомам извне определенной энергии могут наблюдаться лишь переходы атомов из основного состояния в возбужденные (возникает серия Лаймана).
Исследования спектров излучения разреженных газов (т. е. спектров излучения отдельных атомов) показали, что каждому газу присущ вполне определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома — атома водорода.
Швейцарский ученый Бальмер подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
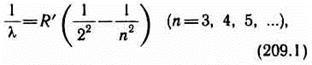
где R'=1,10•107 м-1 — постоянная Ридберга.Так как v = c/l, то формула (209.1) может быть переписана для частот:
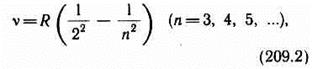
где R=R'с=3,29•1015 с-1 также постоянная Ридберга.
Из выражений (209.1) и (209.2) вытекает, что спектральные линии, отличающиеся различными значениями n, образуют группу или серию линий, называемую серией Бальмера.С увеличением n линии серии сближаются; значение n=¥ определяет границу серии,к которой со стороны больших частот примыкает сплошной спектр.
В дальнейшем (в начале XX в.) в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:
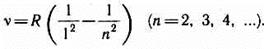
В инфракрасной области спектра были также обнаружены: серия Пашена
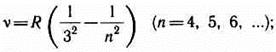
Дата добавления: 2015-10-13; просмотров: 1496;
