Тема 2.2.3 Адіабатний процес. Застосування першого закону термодинаміки до адіабатного процесу. Рівняння адіабати.
План
1. Адіабатний процес.
2. Перший принцип термодинаміки для адіабатного процесу.
3. Рівняння адіабати.
4. Графіки адіабатного та ізотермічного процесів.
Література:
[1] Чолпан П.П. Фізика: Підручник. – К.: Вища к.., 2004. – 567 с. (§ 7.4-7.5 )
1. Адіабатний – це такий процес, який відбувається без теплообміну системи з навколишнім середовищем. Можливо в трьох випадках здійснити процес, який буде адіабатним.
В першому випадку для здійснення адіабатного процесу треба оточити систему такою оболонкою, яка не пропускає теплоти тобто теплопровідність якої дорівнює нулю, але не заважає тому, щоб система виконувала роботу або робота виконувалась над системою. Таку оболонку називають адіабатичною. Прикладом оболонки, близької до адіабатичної, може служити посудина Дьюара.
Другий випадок адіабатичних процесів – це процеси, що відбуваються дуже швидко. При швидкому стиску газу затрачається робота δА, в наслідок чого збільшується внутрішня енергія dU, що викликає підвищення температури. При підвищенні температури деяка кількість теплоти δQ повинна бути передана навколишньому середовищі, що знаходиться при нижчій температурі, але процес теплопередачі вимагає деякого часу, тому при швидкому стиску теплота не встигає поширитись з даного об’єму.
Третій випадок – це процеси, що відбуваються в дуже великих об’ємах газу, наприклад, в атмосфері. Якщо в атмосфері відбудеться зменшення тиску – розрідження, яке виникає внаслідок атмосферної діяльності, то кількість теплоти, яка повинна бути передана із навколишнього простору для того, щоб вирівняти температуру, яка понизилась внаслідок адіабатичного розширення, просто не встигає поширитися упродовж значного проміжку часу.
2При адіабатичному процесі система обмінюється енергією із середовищем тільки в результаті роботи, при цьому вона не дістає і не віддає теплоти, тобто ΔQ = 0.
Перший принцип термодинаміки для цього випадку і нескінченно малих величин має вигляд
dU + δА = 0
де dU – повний диференціал; δА – неповний диференціал. Нехай моль ідеального газу знаходиться під поршнем. Закріпивши поршень, підвищимо температуру газу на dТ. Оскільки об’єм газу залишається сталим, то кількість теплоти, що потрібна для такого нагрівання, дорівнює СVdT. А оскільки при цьому не виконується робота, то ця кількість теплоти дорівнює збільшенню внутрішньої енергії газу dU = СVdT.
Якщо початковий стан (Т,V) буде таким самим, що й у попередньому досліді, але поршень не закріплений, а може вільно переміщуватися при незмінному зовнішньому тиску р, то газ виконуватиме роботу δА = рdV. Оскільки внутрішня енергія газу залежить тільки від температури, то вона змінюється так само, як і у попередньому випадку.
Отже, при адіабатичному процесі система виконує роботу за рахунок внутрішньої енергії, це приводить до зменшення температури системи.
3 Рівняння для адіабатичного процесу: 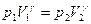 Цей вираз називається рівнянням Пуассона.
Цей вираз називається рівнянням Пуассона.
Де 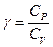 показник адіабати, або коефіцієнт Пуассона.
показник адіабати, або коефіцієнт Пуассона.
Рівняння може мати вигляд: 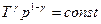 і
і 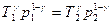
4 Враховуючи, що ΔА = рΔV і ΔU = СVΔT, формула набирає такого вигляду: СVΔT + рΔV = 0.
При адіабатичному розширенні газу, коли збільшується об’єм (ΔV>0), з формули видно, що температура знижується (ΔT < 0), тобто газ охолоджується. Якщо ж ΔV< 0, то ΔT>0, тобто газ нагрівається. Властивість газів охолоджуватись при розширені їх в адіабатичних умовах покладено в основу принципу дії холодильників. Отже, при адіабатичному процесі температура системи може змінюватись, хоча системі теплота не передається. Звідси випливає, що теплоємність системи при адіабатичному процесі дорівнює нулю.
Побудуємо графіки рівнянь:
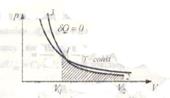 1) pVγ = const (адіабата) і
1) pVγ = const (адіабата) і
2) рV= const (ізотерма)
Диференціюючи рівняння рV= const, отримуємо pdV + Vdp = 0, звідси для ізотерми маємо 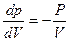 .
.
Диференціюючи рівняння pVγ = const, маємо 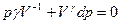 .
.
Звідси 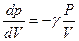
Тангенс кута нахилу адіабати в γ разів більший, ніж ізотерми. Це пояснюється тим, що при адіабатному стиску 1 – 3 тиск газу збільшується не лише внаслідок зменшення його об’єму, як при ізотермічному стиску, але і підвищенням температури.
Контрольні запитання
1 Який процес називають адіабатичним?
2 Який вигляд має рівняння Пуассона?
3 Чому дорівнює теплоємність системи при адіабатичному процесі
Змістовий модуль 2.2 Закони термодинаміки
Тема 2.2.4 Середнє число зіткнень і середня довжина вільного пробігу молекул.(Самостійне вивчення)
План
1 Середня довжина вільного пробігу молекул.
2 Ефективний діаметр молекули
Література:
[1] Чолпан П.П. Фізика: Підручник. – К.: Вища шк., 2004. – 567 с. § 5.1
[3] Дмитрієва В.Ф. Фізика: Навчальний посібник для студентів навчальних закладів І-ІІ рівнів акредитації. –
К: Техніка, 2008. – 648 с § 42
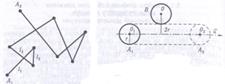
1Середні швидкості молекул газу дуже великі. Вони становлять сотні і навіть тисячі метрів за секунду. Але. здійснюючи безладний рух, молекули газу за нормальних умов зазнають безліч співударів протягом 1 с, і відстані, які вони проходять від однієї точки до другої, набагато більші за переміщення L. Припустимо, що молекула рухається від точки А до точки В (рис. ). Її траєкторія внаслідок співударів цієї молекули з і іншими молекулами є ламаною лінією. Точно простежити за траєкторією частинки, яка прийшла з точки А в точку В, не можна, тому реальне зміщення молекули в газі оцінюють швидкістю дифузії: відношенням її переміщення L з А у В до часу, за який відбулося це переміщення. Швидкість дифузії молекули значно менша за середню швидкість її молекулярного руху.
Щоб оцінити швидкості дифузії молекул, вводять поняття середньої довжини вільного пробігу (λ). Це такий шлях, який проходить молекула.
Й- пізнавши співударів.
Припустимо, що в одиничному об'ємі міститься n0, молекул, кожну з яких можна зобразити у вигляді кульки з радіусом г (рис.). Вважатимемо, що траєкторія цієї молекули А прямолінійна (хоч насправді це й не так), а всі молекули, які зустрічаються на її шляху, нерухомі. На своєму шляху молекула А кілька разів зіткнеться з іншими молекулами, наприклад з В, центри яких лежать не далі ніж на 2r від траєкторії її руху. Отже, можна припустити, що область, в якій дана молекула взаємодіє з іншими, це циліндр радіуса 2r.
 За 1 с рухома молекула зіткнеться з тими молекулами, що є всередині циліндра, і пройде шлях, який чисельно дорівнює її швидкості (υ) . Об'єм такого циліндра V =4πr2 (υ), а середня кількість зіткнень молекули А з молекулами, які є в об'ємі циліндра, дорівнює
За 1 с рухома молекула зіткнеться з тими молекулами, що є всередині циліндра, і пройде шлях, який чисельно дорівнює її швидкості (υ) . Об'єм такого циліндра V =4πr2 (υ), а середня кількість зіткнень молекули А з молекулами, які є в об'ємі циліндра, дорівнює
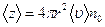 .
.
Визначаючи (z) за формулою, ми виходимо з того, що всі молекули, крім однієї, нерухомі, а насправді всі молекули перебувають у хаотичному русі. Тому у формулу 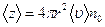 вводять поправочний коефіцієнт √2
вводять поправочний коефіцієнт √2
який показує, що реально зіткнень буде більше:
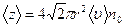
де 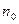 - кількість молекул в одиниці об'єму (концентрація молекул).
- кількість молекул в одиниці об'єму (концентрація молекул).
Середня довжина винного пробігу молекули дорівнює відношенню шляху, пройденого молекулою за 1 с. до кількості зіткнень, які відбулися за цей час:
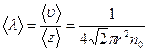
З виразу випливає, що 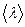 не залежить від температури газу, оскільки з підвищенням температури зростають швидкість
не залежить від температури газу, оскільки з підвищенням температури зростають швидкість 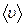 і кількість зіткнень
і кількість зіткнень 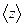 . Для певного газу при незмінній температурі середня довжина вільного пробігу обернено пропорційна тиску газу.
. Для певного газу при незмінній температурі середня довжина вільного пробігу обернено пропорційна тиску газу.
2 Взаємодіючи, молекули можуть зближуватись до деякої найменшої відстані dсф, яку називають ефективним діаметром молекули.
Якщо припустити, що dсф = 2r, то маємо
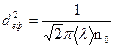
Формули 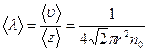 і
і 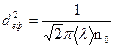 можна використати для обчислення ефективного
можна використати для обчислення ефективного
діаметра молекули газів, довжини вільного пробігу і концентрації молекул.
Контрольні запитання
1. Якими швидкостями характеризують рух молекул газу?
2. Що називають ефективним діаметром молекули?
Змістовий модуль 2.2 Закони термодинаміки
Тема 2.2.5 Коловий процес. Теплові двигуни і холодильні машини.(Самостійне вивчення)
План
1 Коловий процес.
2 Теплові двигуни.
3 Холодильні машини.
Література: [2] За редакцією І.Є. Лопатинського. Зачек І.Р., Кравчук І.М., Романишин Б.М. та ін. Курс
фізики: Навчальний підручник. – Львів: Видавництво «Бескид Біт», 2002 р. – 367 с. (§40 )
[3] Дмитрієва В.Ф. Фізика: Навчальний посібник для студентів навчальних закладів І-ІІ рівнів
акредитації. – К: Техніка, 2008. – 648 с. (§59-61)
1 Коловим процесом (циклом) називається процес, при якому система, пройшовши через ряд станів, повертається у вихідний стан. На діаграмі процесів цикл зображується замкненою кривою.
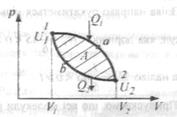
Тіло, яке здійснює коловий процес і обмінюється енергією з іншими тілами, називається робочим тілом. Звичайно таким тілом є газ.
Цикл, який виконує ідеальний газ, можна розбити на процеси розширення (1-2) і стискання (2-1) газу. Робота розширення, яка визначається площею фігури 1a2V2V11, додатна (dV>0), робота стискування, що визначається площею фігури 2b1V1V22, від’ємна (dV<0). Робота, яка виконується газом за цикл: А = А1-2- А2-1.
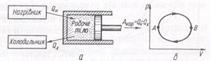 2 Тепловий двигун – це пристрій, який перетворює внутрішню енергію палива в механічну.
2 Тепловий двигун – це пристрій, який перетворює внутрішню енергію палива в механічну.
Будь-який тепловий двигун складається з трьох основних частин: робочого тіла, нагрівника і холодильника. Робоче тіло (газ або пара) під час розширення виконує роботу, одержавши від нагрівника деяку кількість теплоти Qн. Температура нагрівника Т1 залишається сталою за рахунок згорання палива. У процесі стискання робоче тіло передає деяку кількість теплоти Qх холодильнику, який має температуру Т2< Т1. Тепловий двигун має працювати циклічно. Якщо тіло з початкового стану А переводиться в кінцевий стан В, а потім через інші проміжні стани повертається в початковий стан А, то кажуть, що виконується коловий процес, або цикл.
Після закінчення циклу тіло повертається у свій початковий стан, його внутрішня енергія набуває початкового значення.
.Прикладами теплових машин можуть бути парові машини, парові турбіни, двигуни внутрішнього згоряння, реактивні двигуни.
Повсюдне застосування теплових двигунів негативно впливає на навколишнє середовище. Підраховано, що тепер щороку спалюють приблизно 2 млрд т різних видів кам’яного вугілля і близько 1 млрд т нафти. Це призводить до поступового підвищення середньої температури на Землі, що може створити загрозу танення льодовиків і підвищення рівня Світового океану. Крім того, в атмосферу викидається не менш як 120 млн т золи і до 60 млн т отруйного сірчистого ангідриду. Понад 200 млн автомобілів у всьому світі безперервно отруюють атмосферне повітря оксидами вуглецю та азоту, вуглеводнями тощо. І це лише частина шкідливих домішок, що потрапляють в атмосферу. Із збільшенням потужностей теплових і атомних електростанцій різко зростає потреба на воду.
 3 Усі теплові машини працюють за так званим прямим циклом, тобто здійснюють такий замкнений процес, при якому теплота перетворюється в роботу. Проте машину можна примусити працювати і за зворотним циклом, коли внаслідок виконаної роботи від системи віднімається деяка кількість теплоти. У цьому разі теплота переходитиме від менш нагрітого тіла до більш нагрітого, а машина перетвориться в холодильну машину.
3 Усі теплові машини працюють за так званим прямим циклом, тобто здійснюють такий замкнений процес, при якому теплота перетворюється в роботу. Проте машину можна примусити працювати і за зворотним циклом, коли внаслідок виконаної роботи від системи віднімається деяка кількість теплоти. У цьому разі теплота переходитиме від менш нагрітого тіла до більш нагрітого, а машина перетвориться в холодильну машину.
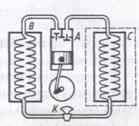
Прикладом найбільш поширеної холодильної машини тепер є домашній холодильник. Принцип його роботи: агрегат, за допомогою якого створюється низька температура в холодильній камері і самому холодильнику, складається з компресора А, конденсатора В, крана К і випарника С, виготовленого у вигляді трубок у стінках холодильної камери.
Охолодну систему холодильника заповнюють рідиною, яка легко випаровується (фреон, аміак, сірчистий ангідрид та ін..); її називають холодоагентом.
Холодоагент за допомогою компресора, який працює від електродвигуна, стискається в конденсаторі – змійовику з трубок невеликого перерізу. Під час стискання холодоагент переходить у рідкий стан, охолоджується, віддаючи теплоту в навколишнє середовище (трубки змонтовані на задній стінці холодильника), і надходить у трубки випарника, які оточують холодильну камеру. Холодоагент випаровується тому, що трубки випарника мають діаметр, більший від діамета трубок конденсатора, і тиск газу в них різко зменшується. Крім того, і сам конденсатор створює у випарнику нижчий тиск. Процес випаровування супроводиться поглинанням теплоти від стінок змійовика-випарника, повітря і продуктів, що містяться в холодильній камері. Температура в холодильній камері і, отже, в усьому холодильнику знижується. Газоподібний холодоагент надходить знову в компресор, і процес повторюється багато разів.
Контрольні запитання
1 Що таке коловий процес?
2 Що уявляє собою тепловий двигун?
3 Розкажіть принцип дії теплового двигуна.
4 Який принцип роботи холодильної машини?
5 Що називають холодоагентом?
Змістовий модуль 2.2 Закони термодинаміки
Лекція № 8
Дата добавления: 2015-10-13; просмотров: 9359;
