Тема 2.2.1 Первый закон термодинамики. Робота термодинамічної системи. Внутрішня енергія і теплоємність ідеального газу.
План
1 Дві форми передавачі енергії. Перший закон термодинаміки
2 Робота термодинамічної системи.
3 Внутрішня енергія.
4 Теплоємність.
Література:
[1] Чолпан П.П. Фізика: Підручник. – К.: Вища к.., 2004. – 567 с. (§ 7.2-7.3 )
1Розглянемо термодинамічну систему, для якої механічна енергія не змінюється, а змінюється лише її внутрішня енергія. Можливі дві форми передавання енергії від одного тіла до іншого, а отже, і зміни внутрішньої енергії системи.
Перша з них зводиться до того, що енергія впорядкованого руху одного тіла переходить в енергію впорядкованого руху іншого тіла або його частин. Це може відбуватися під час взаємодії макроскопічних тіл, розміри яких у багато разів більші за розміри окремих атомів або молекул. Таку форму передавання енергії називають роботою. Наприклад, газ, що розширюється в циліндрі двигуна внутрішнього згоряння, переміщує при цьому поршень і передає йому енергію у формі роботи.
Друга форма передавання енергії здійснюється при безпосередньому обміні енергією між частинками взаємодіючих тіл, що рухаються хаотично. За рахунок переданої тілу енергії підсилюється невпорядкований рух його частинок, тобто збільшується рух його частинок, тобто збільшується внутрішня енергія тіла. Таку форму передавання енергії в термодинаміці називають теплотою. Так, наприклад, при дотику холодного тіла і гарячого молекули другого тіла, які швидко рухаються, стискаються з молекулами першого тіла, що рухається повільніше, і передають їь частину своєї кінетичної енергії. Внаслідок цього внутрішня енергія першого тіла збільшується, а другого – зменшується, а їх температури вирівнюються.
Теплота подібно до роботи є формою передавання енергії, а зовсім не видом енергії. Отже, можна говорити про дві форми передачі енергії від одних тіл до інших: у формі роботи і у формі теплоти.
Відповідно до закону збереження енергії при довільному способі переходу системи з першого стану у другий зміна внутрішньої енергії ΔU = U2 - U1 дорівнюватиме різниці між кількістю теплоти Q, отриманою системою, і роботою А, яка виконана системою проти зовнішніх сил: ΔU = Q – А, або
Q = ΔU + А
Це рівняння являє собою математичний вираз першого закону термодинаміки: теплота надана системі, витрачається на збільшення її внутрішньої енергії і на виконання системою роботи проти зовнішніх сил.
Робота, що виконується машиною за один цикл, дорівнює підведеній ззовні теплоті Q. Цей висновок дає змогу сформулювати перший закон термодинаміки так: неможливо побудувати періодично діючий двигун, який виконував би роботу без підведення енергії ззовні або виконував би роботу більшу, ніж кількість переданої йому ззовні енергії (вічний двигун першого роду неможливий).
2 Знайдемо роботу, яка виконується газом при зміні його об’єму. Нехай газ знаходиться в циліндричній посудині з поршнем.
Якщо газ, переміщує поршень на нескінченно малу відстань dl, то він виконує над ним роботу
δА = Fdl = pSdl = pdV,
де S – площа поршня, Sdl – зміна об’єму газу.
Повну роботу А, яка виконана газом при зміні його об’єму від V1 до V2 при ізобарному процесі, знайдемо інтегруванням:
А = 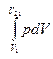 =р(V2-V1).
=р(V2-V1).
Аналітичний вираз роботи ізотермічного розширення ідеального газу дістанемо з використанням рівняння Менделєєва-Клапейрона 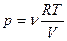 , тоді
, тоді
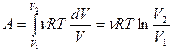 .
.
Величина роботи А залежить не тільки від початкового і кінцевого станів тіла, а й від того, яким є термодинамічний процес, тобто по якій кривій відбувається зміна стану.
Якщо процес відбувається по замкненій кривій і газ повернувся до початкового стану, то повна робота, виконана газом, не дорівнює нулю.
3 Внутрішня енергія U – енергія хаотичного (теплового) руху мікрочастинок системи (молекул, атомів, електронів, ядер і тощо) і енергія взаємодії цих частинок. До внутрішньої енергії не належать кінетична енергія системи як цілого і потенціальна енергія системи у зовнішніх полях.
Внутрішня енергія ідеального газу:
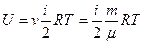 .
.
4 Теплоємністю тіла називається фізична величина, яка числово дорівнює кількості теплоти, яку необхідно надати тілу, щоб підвищити його температуру на один кельвін:
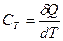
Значення СТ залежить від маси тіла, його хімічного складу, термодинамічного стану і від процесу зміни стану тіла, в якому надходить теплота 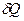 .
.
Питомою теплоємністю с називається величина, що числово дорівнює кількості теплоти, яку слід надати одиниці маси цієї речовини для підвищення її температури на 1К:
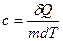
Молярною теплоємністю С називається фізична величина, яка числово дорівнює кількості теплоти, яку треба надати одному молю речовини для підвищення його температури на 1 К:
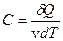
де v = m/μ – число молей газу.
Між молярною теплоємністю С і питомою теплоємністю с існує співвідношення: С = μс.
Оскільки величина теплоємності газу залежить від умов, при яких йому надається кількість теплоти, то розрізнюють теплоємність при сталому об’ємі СV і теплоємність при сталому тиску Ср. в першому випадку нагрівання газу відбувається при сталому об’ємі, а в другому – при сталому тиску.
Контрольні запитання
1. Назвіть форми передачі енергії від одного тіла до іншого.
2. Сформулюйте перший закон термодинаміки.
3. Що називають внутрішньою енергією?
4. Що таке теплоємність тіла?
5. Що таке питома теплоємність?
6. Що таке молярна теплоємність?
Змістовий модуль 2.2 Закони термодинаміки
Тема 2.2.2 Застосування першого закону термодинаміки до ізопроцесів.(Самостійне вивчення)
План
1 Перший закон термодинаміки при ізохорному процесі.
2 Перший закон термодинаміки при ізобарному процесі.
3 Перший закон термодинаміки при ізотермічному процесі.
Література: [3] Дмитрієва В.Ф. Фізика: Навчальний посібник для студентів навчальних закладів І-ІІ рівнів акредитації. – К: Техніка, 2008. – 648 с. (§56-57)
1Перший закон термодинаміки формулюють у вигляді такого твердження: не можна побудувати перпеттум мобіле першого роду.
Перший закон термодинаміки – це закон збереження і перетворення енергії: у різних процесах, які відбуваються в природі, енергія не виникає з нічого і не знищується, а тільки перетворюється з одних видів в інші.
Кількість теплоти, надана тілу, втрачається на збільшення його внутрішньої енергії і на виконання тілом роботи над зовнішніми тілами: : Q = ∆U + A
Так формулюють перший закон термодинаміки – закон збереження енергії в застосуванні до теплових процесів.
Дата добавления: 2015-10-13; просмотров: 2289;
