Диссоциация сильных электролитов
Сильные электролиты в растворе полностью диссоциированы на ионы. Ионы взаимодействуют между собой и ведут себя так, будто их концентрация меньше их действительной концентрации. Для учета взаимодействия между ионами в растворе вводится понятие активности ионов.
Активность иона - a - это концентрация иона, проявляющаяся в его свойствах. Например, активность ионов Na+ и Cl- в 1М растворе NaCl равна 0,65М. Это значит, что ионы ведут себя так, словно их концентрация равна не 1 моль/л, а 0,65 моль/л.
Коэффициент активности - f - это отношение активности иона a к концентрации C: f = a/c или a = fc.
Если f=1, то активность равна концентрации, т.е. ионы свободны и не взаимодействуют между собой. Это имеет место в очень разбавленных растворах, в растворах слабых электролитов и т.д.
Если f<1, то активность меньше концентрации, т.е. ионы взаимодействуют между собой. Чем меньше f, тем больше взаимодействие между ионами.
Коэффициент активности зависит от ионной силы раствора m - чем больше ионная сила, тем меньше коэффициент активности.
Ионная сила раствора m зависит от зарядов Z и концентраций C ионов: 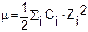
Пример. Найти ионную силу m раствора, 1 литр которого содержит 0,02 моль Ca(NO3)2 и 0,05 моль Na2SO4.
Решение. Считая, что Ca(NO3)2 и Na2SO4 полностью диссоциированы, имеем [Ca2+]=0,02 M, [NO3-]=0,04M, [Na+]=0,1M,
[SO42-]=0,05M. Суммируя по каждому иону, находим:
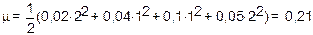 .
.
Для электролитов, имеющих концентрацию С, ионная сила равна в зависимости от типа электролита:
A+B- m = 1/2(С×12+С×12) = С NaOH, HCl
A2+B2- m = 1/2(2С×12+С×22) = 3С H2SO4, MgCl2
A2+B2- m=1/2(С×22+С×22) = 4С CuSO4, MgSO4
A3+B3- m=1/2(С×32+3С×12) = 6С AlCl3, Na3PO4
Коэффициент активности зависит от заряда иона, чем больше заряд иона, тем меньше коэффициент активности. Математически зависимость коэффициента активности f от ионной силы m и заряда иона z записывается с помощью формулы Дебая-Хюккеля:
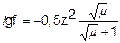 , а при m < 0,01
, а при m < 0,01 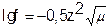
Коэффициенты активности ионов можно определить с помощью следующей таблицы:
| Z | m | 0,001 | 0,005 | 0,01 | 0,05 | 0,1 | 0,2 | |
| ±1 | f | 0,96 | 0,92 | 0,90 | 0,81 | 0,78 | 0,70 | |
| ±2 | 0,86 | 0,72 | 0,63 | 0,44 | 0,33 | 0,24 | ||
| ±3 | 0,73 | 0,51 | 0,39 | 0,15 | 0,08 | 0,02 |
Пример. Найти активности ионов в 0,025М CuSO4.
Решение: m=0,1; f(Cu2+) = f(SO42-) = 0,33;
a(Cu2+) = a(SO42-) = 0,025×0,33 = 8,25×10-3M.
Дата добавления: 2015-09-07; просмотров: 920;
