Диссоциация координационных соединений
Координационные соединения в растворе полностью диссоциируют на ионы внутренней и внешней сфер.
K4[Fe(CN)6] ® 4K+ + Fe(CN)64- a=1
[Ag(NH3)2]NO3 ® Ag(NH3)2+ + NO3- a=1
Ионы внутренней сферы, то есть, комплексные ионы, диссоциируют на ионы металла и лиганды как слабые электролиты, по ступеням.
Ag(NH3)2+  Ag(NH3)+ + NH3 K1 =
Ag(NH3)+ + NH3 K1 = 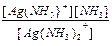 = 1,2´10-4
= 1,2´10-4
Ag(NH3)+  Ag+ + NH3 K2 =
Ag+ + NH3 K2 = 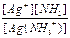 = 4,8´10-4
= 4,8´10-4
или суммарно имеем: 
Ag(NH3)2+  Ag+ + 2NH3 K1-2 = K1´ K2 =
Ag+ + 2NH3 K1-2 = K1´ K2 = 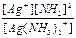 = 5,8´10-8
= 5,8´10-8
где К1, К2, K1-2 называются константами нестойкости и характеризуют диссоциацию комплексов. Чем меньше константа нестойкости, тем меньше диссоциирует комплекс, тем он устойчивее.
Пример. Найти концентрации [NH3], [Ag(NH3)+] и [Ag+] в 0,8М растворе [Ag(NH3)2]NO3.
Решение. Для первой стадии диссоциации Ag(NH3)2+ (см. выше) имеем: K1 = 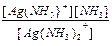 = 1,2´10-4.
= 1,2´10-4.
Поскольку комплексный ион мало диссоциирует, то можно пренебречь количеством диссоциировавших ионов по сравнению с недиссоциировавшими и записать [Ag(NH3)2+] = 0,8М. Пренебрегая диссоциацией по второй ступени, имеем [Ag(NH3)+] = [NH3].
Отсюда K1 = [NH3]2/0,8 = 1,2´10-4 и далее
[NH3] = [Ag(NH3)+] = 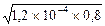 = 1´10-2М.
= 1´10-2М.
Для второй ступени диссоциации имеем:
K2 = 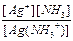 = 4,8´10-4 и поскольку [Ag(NH3)+] = [NH3], то
= 4,8´10-4 и поскольку [Ag(NH3)+] = [NH3], то
[Ag+] = 4,8´10-4М.
Увеличение концентрации лиганда уменьшает количество свободных ионов комплексообразователя в растворе. Это положение аналогично эффекту общего иона для растворов слабых электролитов и гетерогенных равновесий.
Пример. Найти концентрации [Ag(NH3)+] и [Ag+] в 0,8М растворе [Ag(NH3)2]NO3, содержащем в избытке 0,8М раствор [NH3].
Решение. Имеем: [NH3] = 0,8М и [Ag(NH3)2+] = 0,8М и далее K1 = 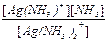 =
= 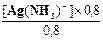 = 1,2´10-4
= 1,2´10-4
откуда [Ag(NH3)+] = 1,2´10-4М.
Также имеем K2 = 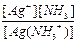 =
= 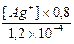
 = 4,8´10-4 откуда
= 4,8´10-4 откуда
[Ag+] = 7,2´10-8М
Таким образом, добавление избытка аммиака в соответствие с приведенным выше правилом уменьшило диссоциацию комплексного иона [Ag(NH3)2+]: концентрация в растворе [Ag(NH3)+] уменьшилась с 1.0´10-2М до 1,2´10-4М, а концентрация [Ag+] уменьшилась с 4,8´10-4М до7,2´10-8М.
Пример. Найти растворимость (в моль/л) хлорида серебра AgCl (Ks = 1,8´10-10) в 1М растворе NH3 (для Ag(NH3)2+ имеем
K1-2 = 5,8´10-8).
Решение. Имеем два равновесия:
AgCl  Ag+ + Cl- и Ag(NH3)2+
Ag+ + Cl- и Ag(NH3)2+  Ag+ + 2NH3
Ag+ + 2NH3
s s
Ионы Ag+ , образующиеся при растворении AgCl, будут практически полностью связаны в комплексный ион Ag(NH3)2+ в силу его малой диссоциации. Отсюда: s = [Cl-] = [Ag(NH3)2+].
Полагая, что [NH3] = 1М, определяем концентрацию свободных ионов серебра:
K1-2 = 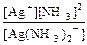 =
= 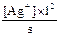 = 5,8´10-8 и [Ag+] = s´5,8´10-8.
= 5,8´10-8 и [Ag+] = s´5,8´10-8.
Подставляем найденное значение [Ag+] в выражение для Кs(AgCl):
Ks = [Ag+][Cl-] = s´5,8´10-8´s = 1,8´10-10 и определяем растворимость хлорида серебра в одномолярном растворе аммиака:
s2 = 1,8´10-10/5,8´10-8 = 0,31´10-2 и s = 0,056М.
Видно, что AgCl растворим в растворах аммиака.
Дата добавления: 2015-09-07; просмотров: 1118;
