Химические свойства соединений щелочных металлов
Гидриды щелочных металлов - солеобразные вещества - например, Na+1Н-1, взаимодействуют с водой и кислотами:
NaH + H2O ® NaOH + H2
NaH + HCl ® NaCl + H2
Оксиды щелочных металлов являются активными основными оксидами:
Na2O + H2O ® NaOH
Na2O _ CO2 ® Na2CO3
Na2O + 2HCl ® 2NaCl + H2O
Гидроксиды щелочных металлов являются растворимыми гидроксидами - щелочами. При этом их степень диссоциации увеличивается от LiOH к CsOH.
NaOH ® Na+ + OH- (a = 1)
2NaOH + CO2 ® Na2CO3 + H2O
2NaOH + H2SO4 ® Na2SO4 + 2H2O
2NaOH + ZnO 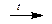 Na2ZnO2 + H2O
Na2ZnO2 + H2O
3NaOH + Al(OH)3 ® Na3[Al(OH)6]
3NaOH + FeCl3 ® Fe(OH)3¯ + 3NaCl
Пероксиды Na2O2 и супероксиды KO2 являются сильными окислителями, они разлагаются водой с образованием H2O2 и O2:
Na2O2 + 2H2O ® 2NaOH + H2O2
2KO2 + 2H2O ® 2KOH ® H2O2 + O2
Соли щелочных металлов хорошо растворяются в воде (кроме солей лития). Соли лития окрашивают пламя горелки в карминово-красный цвет, соли натрия - в желтый цвет, соли калия - в светло-фиолетовый цвет. Соли щелочных металлов со слабыми кислотами гидролизуются, создавая щелочную среду.
NaCl - поваренная соль. Человек потребляет 5-10 кг соли в год. NaNO3 - азотное удобрение. Сода Na2CO3 используется в производстве стекла, мыла, в текстильной и бумажной промышленности. Избыток солей натрия в почве - засоление почв - снижает их плодородие. Соли калия KCl, KNO3, KPO3 являются удобрениями.
Дата добавления: 2015-09-07; просмотров: 798;
