Буферные растворы.
Буферные растворы - это растворы, имеющие постоянную определенную концентрацию ионов водорода. рН этих растворов не меняется при разбавлении и мало меняется при добавлении небольших количеств кислот и щелочей. Буферные растворы состоят из растворов слабой кислоты и ее соли с сильным основанием или из раствора слабого основания и его соли с сильной кислотой. Рассмотрим оба возможных случая.
I. Раствор слабой кислоты НА, концентрация - Скисл, и ее соли, сильного основания ВА, концентрация Ссоли. Например, ацетатный буфер - раствор уксусной кислоты и ацетата натрия
CH3COOH + CH3COONa.
В общем случае имеем смесь: НА + ВА
HА  Н+ + А- (a<<1)
Н+ + А- (a<<1)
ВА  В+ + А- (a=1).
В+ + А- (a=1).
Поскольку НА - слабый, а ВА - сильный электролит, имеем [HA] = Cкисл. и [A-] = Ссоли.
Подставим найденные значения и выражение для константы диссоциации кислоты НА:
Ккисл = 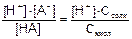 [H+] = Ккисл×Скисл /Ссоли.
[H+] = Ккисл×Скисл /Ссоли.
рН = рКкисл + lg(Ссоли/Скисл).
Например, в случае ацетатного буферного раствора
(рКСН3СООН = 4,75) его рН будет равна 4,75, если Ссоли = Скислоты. Очевидно, что при разбавлении концентрации соли и кислоты будут уменьшаться одинаково, а соотношение Ссоли / Скислоты и рН не будут меняться.
II. Раствор слабого основания ВОН, концентрация - Сосн и его соли сильной кислоты ВА, концентрации Ссоли. Например, аммиачный буфер - раствор гидроксида аммония и хлорида аммония NH4OH + NH4Cl. В общем случае имеем: ВОН + ВА:
ВОH  В+ + ОН- (a<<1)
В+ + ОН- (a<<1)
ВА  В+ + А- (a=1).
В+ + А- (a=1).
Поскольку ВОН - слабый, а ВА - сильный электролит, имеем [ВОH] = Cосн. и [В+] = Ссоли. Подставим эти значения в выражения для константы диссоциации основания ВОН.
Косн = 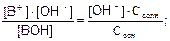 [OH-] = Косн×Сосн /Ссоли.
[OH-] = Косн×Сосн /Ссоли.
рОН = рКосн + lg(Ссоли/Сосн), рН = 14 - рКосн + lg(Ссоли/Сосн).
Например, в случае аммиачного буферного раствора
рК (NH4OH) = 4,75 и Сосн = Ссоли, имеем рН = 14 - 4,75 = 9,25.
Из приведенной формулы видно, что в этом случае рН не зависит от разбавления, так как отношение Ссоли /Скисл остается при этом неизменным.
Задача. Как изменится рН при добавлении 1 мл ! М раствора HСl: а) к 100 мл Н2О; б) к 100 мл буферной смеси, содержащей 0,1 М СН3СООН и 0,1 М СН3СООNа. Изменением объема можно пренебречь.
Решение. а) рН воды до прибавления кислоты равен 7. При смешении 1 мл 1М раствора HCl и 100 мл воды объем увеличивается в 100 раз, а концентрация кислоты будет в 100 раз меньше, т.е. [HCl]=10-2М. Поскольку HCl - сильная кислота, то [H+]=10-2М и рН = 2. Таким образом, при добавлении 1 мл 1М раствора HСl к 100 мл воды рН изменяется с 7 до 2, т.е. на 5 единиц.
б) рН буферного раствора до прибавления кислоты равен 4,75. При добавлении раствора HCl к буферной смеси пройдет реакция: HCl + CH3COONa ® CH3COOH + NaCl,
в результате которой концентрация CH3COONa уменьшается, а концентрация СН3СООН - увеличивается. Найдем число моль (n) веществ до реакции (n = CM × V).
n (HCl) = 1 моль/л × 0,001 л = 0,001 моль.
n(CH3COOH) = n(CH3COONa) = 0,1 моль/л × 0,1 = 0,01 моль.
После реакции n(HCl) = 0, n(CH3COOH) = 0,01 + 0,001 = 0,011 моль, n(CH3COONa) = 0,01 - 0,001 = 0,009 моль.
Считая объем неизменным и равным V = 0,1 л, имеем:
C(CH3COOH) = 0,11 М и С(CH3COONa) = 0,09 М. Значения концентраций подставляем в формулу расчета рН:
рН = рКкисл + lg(Ссоли/Скисл) = 4,75 + lg(0,09/0,11) = 4,75-0,09 = 4,66. Таким образом, при добавлении 1 мл 1М раствора кислоты к 100 мл буферного раствора рН изменяется на 4,75 - 4,66 = 0,09.
Малое изменение рН при добавлении соляной кислоты к ацетатному буферу обусловлено превращением сильной кислоты (HCl) в слабую кислоту (СН3СООН). При добавлении щелочи, например NaOH, к ацетатному буферу происходит реакция щелочи с уксусной кислотой с образованием ацетата натрия. Если количество добавляемой щелочи мало по сравнению с количеством буфера, то изменение концентрации кислоты и соли в буфере будут невелики, и рН раствора будет меняться незначительно.
Дата добавления: 2015-09-07; просмотров: 1531;
