Протолитическая теория кислот и основания
Причина диссоциации электролитов - их взаимодействие с водой. Вода образует при диссоциации катион водорода и анион гидроксила. Катион водорода - протон - имеет малый радиус
(»10-15 м) и в воде гидратирован - его обычное координационное число равно четырем. Формула гидрата протона - Н9О4+, но для простоты ее записывают как Н3О+. В растворах протоны переходят от одних соединений к другим.
HNO2 + H2O  H3O+ + NO2-
H3O+ + NO2-
кислота 1 основание 2 кислота 2 основание 1
Протолиз - процесс передачи протона.
Протолиты- кислоты и основания, отдающие и принимающие протоны.
Протолитическое равновесие - кислотно-основное равновесие - ионно-молекулярное равновесие, устанавливающееся после передачи протона. К протолитическим процессам относятся процессы диссоциации, ионные реакции в растворах, реакции гидролиза.
Кислота - молекула или ион, способная отдавать протон. Каждой кислоте соответствует сопряженное с нею основание. Сила кислот характеризуется константой кислоты Кк.
H2CO3 + H2O  H3O+ + HCO3- Kк = 4´10-7.
H3O+ + HCO3- Kк = 4´10-7.
NH4+ + 2H2O  NH3´H2O + H3O+ Kк = 6´10-10.
NH3´H2O + H3O+ Kк = 6´10-10.
[Al(H2O)6]3+ + H2O  [Al(H2O)5OH]2+ + H3O+ Kк = 9´10-6.
[Al(H2O)5OH]2+ + H3O+ Kк = 9´10-6.
Основание- молекула или ион, способная принимать протон. Каждому основанию соответствует сопряженная с ним кислота. Сила оснований характеризуется константой основания Ко.
NH3´H2O (H2O)  NH4+ + OH- Ко = 1,8´10-5.
NH4+ + OH- Ко = 1,8´10-5.
C5H5N + H2O  C5H5NH+ + OH- Ко = 1,8´10-5.
C5H5NH+ + OH- Ко = 1,8´10-5.
Амфолиты - протолиты, способные к отдаче и к присоединению протона.
HCO3- + H2O  H3O+ + CO32- HCO3- - кислота
H3O+ + CO32- HCO3- - кислота
HCO3- + H2O  H2CO3 + OH- HCO3- - основание
H2CO3 + OH- HCO3- - основание
Для воды имеем: H2O+ H2O  H3O+ + OH-
H3O+ + OH-
К(Н2О) = [H3O+][OH-] = 10-14 и pH = -lg[H3O+].
Константы Kк и Ко для сопряженных кислот и оснований связаны между собой.
HA + H2O  H3O+ + A- Kк =
H3O+ + A- Kк = 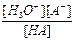
A- + H2O  HA + OH- Ко =
HA + OH- Ко = 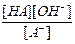
Отсюда Kк´Ко = 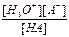 ´
´ 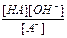 = [H3O+]´[OH-] = К(Н2О)
= [H3O+]´[OH-] = К(Н2О)
Дата добавления: 2015-09-07; просмотров: 933;
