Типичные восстановители и окислители
Восстановители:а) металлы - чем меньше потенциал ионизации, тем сильнее восстановительные свойства; б) соединения элементов в низших степенях окисления (NH3, H2S, HBr, HI и др.), у которых все орбитали заполнены и могут только отдавать электроны.
Окислители:а) неметаллы (F2, Cl2, Br2, O2 и др.) - чем больше сродство к электрону, тем сильнее окислительные свойства; б) ионы металлов в высоких степенях окисления (Fe3+, Sn4+, Mn4+ и др.); в) соединения элементов в высших степенях окисления (KMnO4, K2Cr2O7, NaBiO3, HNO3, H2SO4(конц.) и др.), у которых уже отданы все валентные электроны и могут быть только окислителями.
Соединения элементов в промежуточных степенях окисления (HNO2, H2SO3, H2O2 и др.) могут проявлять окислительные и восстановительные свойства в зависимости от окислительно-восстановительных свойств второго реагента.
H2SO3 + 2H2S = 3S + 3H2O
окисл. восст.
H2SO3 + Br2 + H2O = H2SO4 + 2HBr
восст. окисл.
Пример:
| Na0 | 3s1 | восстановитель (сильный) |
| Na+1 | 3s0 | окислитель (слабый) |
| F- | 2s22p6 | восстановитель (слабый) |
| F0 | 2s22p5 | окислитель (сильный) |
| S-2 | 3s23p6 | восстановитель |
| S0 | 3s23p4 | восстановитель, окислитель |
| S+4 | 3s23p0 | восстановитель, окислитель |
| S+6 | 3s03p0 | окислитель |
Окислители, принимая электроны, то есть, восстанавливаясь, переходят в восстановленную форму:
F2 + 2e ® 2F-
окисл. восст.
Восстановители, отдавая электроны, то есть, окисляясь, переходят в окисленную форму:
Na0 - 1e ® Na+
восст. окисл.
Таким образом, как окислители, так и восстановители существуют в окисленной (с более высокой степенью окисления элемента) и восстановленной (с более низкой степенью окисления элемента) формах. При этом для окислителей более характерен переход из окисленной в восстановленную форму, а для восстановителей характерен переход из восстановленной в окисленную форму. Обратные процессы не характерны, и мы не считаем, например, что F- является восстановителем, а Na+ - окислителем.
Равновесие между окисленной и восстановленной формами характеризуется с помощью окислительно-восстановительного потенциала, который зависит от концентраций окисленной и восстановленной форм, реакции среды, температуры и т.д. Его можно рассчитать по уравнению Нернста:
E = Eo + 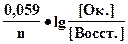
где [Oк.] - молярная концентрация окисленной формы;
[Восст.] - молярная концентрация восстановленной формы;
n - число электронов, участвующих в полуреакции;
Е0 - стандартное значение окислительно-восстановительного потенциала; Е = Е0, если [Восст.] = [Ок] = 1 моль/л;
Величины стандартных электродных потенциалов Е0 приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений: Чем положительнее величина Е0, тем сильнее окислительные свойства, и чем отрицательнее значение Е0, тем сильнее восстановительные свойства.
Например:
F2 + 2e ® 2F- Е0 = 2,87 в - сильный окислитель
Na+ + 1e ® Na0 Е0 = -2,71 в - сильный восстановитель
(процесс всегда записывается для реакций восстановления).
Поскольку окислительно-восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, то она характеризуется значением разности стандартных электродных потенциалов окислителя (Е0ок) и восстановителя (Е0восст) - электродвижущей силой (э.д.с.) DЕ0:
DЕ0 = Е0ок - Е0восст,
Э.д.с. реакции DЕ0 связана с изменением свободной энергии Гиббса DG : DG = -nFDЕ0 , а с другой стороны, DG связана с константой равновесия К реакции уравнением DG = -2,3RTlnK.
Из последних двух уравнений следует зависимость между э.д.с. и константой равновесия реакции:
DЕ = (2,3RT/nF)lnK.
Э.д.с. реакции при концентрациях отличных от стандартных (т.е. не равных 1 моль/л) DЕ равна:
DЕ = DЕ0 - (2,3RT/nF)lgK или DЕ = DЕ0 - (0,059/n)lgK.
В случае равновесия DG = 0 и следовательно DЕ =0. Откуда DЕ = (0,059/n)lgK и К = 10 nDЕ /0,059.
Для самопроизвольного протекания реакции должно выполняться требование: DG <0 или К>>1, которым соответствует условие DЕ0>0. Поэтому для определения возможности протекания данной окислительно-восстановительной реакции необходимо вычислить значение DЕ0. Если DЕ0>0, реакция идет. Если DЕ0<0, реакция не идет.
Пример 1. Определить возможность протекания реакции
2FeCl3 + 2KI ® 2FeCl2 + 2KCl + I2
Решение: Находим, что окислителем является ион Fe+3, восстанавливающийся до Fe+2, а восстановителем - I-, окисляющийся до I2. Находим по таблице значения стандартных электродных потенциалов: E0(Fe+3/Fe+2) = 0,77 в и E0(I2/2I-) = 0,54 в. Вычисляем DЕ0:
DЕ0 = Е0ок - Е0восст = 0,77 - 0,54 = 0,23 в >0.
Реакция возможна, так как DЕ0 > 0.
Пример 2. Определить возможность протекания реакции
2 KMnO4 + 16 HCl ® 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O.
Решение. Находим, что окислителем является перманганат-ион MnO4-, переходящий в Mn+2, а восстановителем - хлорид-ион, переходящий в газообразный хлор Cl2. Определяем по таблице их потенциалы: E0(MnO4-/Mn+2) = 1,51 в и E0(Cl2/2Cl-) = 1,36 в. Вычисляем
DЕ0 = Е0ок - Е0восст = 1,51 - 1,36 = 0,15 в >0.
Реакция возможна, так как DЕ0 > 0.
Дата добавления: 2015-09-07; просмотров: 1596;
