Классификация ОВР
1. Реакции межмолекулярного окисления-восстановления - окислитель и восстановитель входят в состав разных веществ:
2Fe + 3Cl2 = 2FeCl3
восст. окисл.
2. Реакции диспропорционирования - элемент в промежуточной степени окисления является окислителем и восстановителем:
2KOH + Cl2 = KCl + KClO + H2O
3HNO2 = HNO3 + 2NO + H2O
В этих реакциях хлор и N+3 являются окислителями и восстановителями.
3. Реакции внутримолекулярного окисления-восстановления - окислитель и восстановитель входят в состав одного вещества:
2KClO3 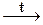 2KCl + 3O2
2KCl + 3O2
NH4NO3 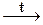 N2O + 2H2O
N2O + 2H2O
В этих реакциях О-2, Cl+5 и N-3, N+5 являются соответственно восстановителями и окислителями.
Следует отметить, что направление протекания ОВР и характер продуктов реакции зависят от окислительно-восстановительных свойств реагирующих веществ и характера среды (кислая, нейтральная или щелочная). Например, перманганат калия KMnO4, который проявляет только окислительные свойства, при переходе от кислой к нейтральной и щелочной среде образует разные продукты восстановления и его окислительно-восстановительный потенциал уменьшается:
pH < 7: MnO4- + 5e ® Mn+2 (бесцветный) Е0 = +1,51 в
pH = 7: MnO4- + 3e ® MnO2 (коричневый) Е0 = +0,60 в
pH > 7: MnO4- + 1e ® MnO4-2 (зеленый) Е0 = +0,56 в
Соединения хрома (VI) являются сильными окислителями в кислой среде (Е0 = +1,33 в), восстанавливаются до Cr+3, а соединения хрома (III) в щелочной среде проявляют восстановительную способность (Е0 = -0,13 в), окисляясь в соединения хрома (VI).
pH £ 7: Cr2O72- + 6e ® 2Cr+3 (синий)
pH > 7: CrO42- + 3e ® [Cr(OH)6]3- (зеленый)
Пероксид водорода Н2О2, содержащий кислород в промежуточной степени окисления -1, проявляет окислительные или восстановительные свойства, и в зависимости от рН раствора изменяются его электродный потенциал и продукты, до которых он восстанавливается или окисляется.
Н2О2 - окислитель:
рН > 7: Н2О2 + 2Н+ + 2e® 2Н2О
рН ³ 7: Н2О2 + 2e® 2ОН-
Н2О2 - восстановитель:
рН > 7: Н2О2 - 2e® О2+ 2Н+
рН ³ 7: Н2О2 + 2ОН- - 2e® О2 + 2Н2О
Таким образом, для правильного написания ОВР следует обязательно учитывать условия протекания данной реакции.
Дата добавления: 2015-09-07; просмотров: 1280;
