III. Кривая титрования слабого основания сильной кислотой.
При построении кривой титрования слабого основания сильной кислотой исходят из тех же соображений, что и в случае титрования слабой кислоты щелочью. В первоначальный момент рН раствора определяется диссоциацией слабого основания. До точки эквивалентности в растворе будет присутствовать буферная смесь, состоящая из неоттитрованного слабого основания и его соли. В точке эквивалентности находится только соль слабого основания и сильной кислоты, которая подвергается гидролизу и создает кислую среду. За точкой эквивалентности рН определяется избыточным содержанием в растворе сильной кислоты.
Пример.
Построить кривую титрования 10,0 мл 0,1 М NH4OH раствором 0,1 М HCl.
Решение:
Расчетные данные приведены в табл.5.
В первоначальный момент (кислота не добавлена) рН раствора определяется по формуле
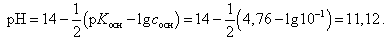 (19)
(19)
Таблица 5.
Расчет кривой титрования 10,0 мл 0,1 М NH4OH раствором 0,1 М HCl
| № | V(HCl),мл | 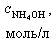
| 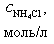
| 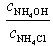
| [H+],моль/л | pH |
| 1. | 0,00 | 0,10 | - | - | - | 11,12 |
| 2. | 2,50 | 0,06 | 0,020 | 3,000 | - | 9,72 |
| 3. | 5,00 | 0,03 | 0,030 | 1,000 | - | 9,24 |
| 4. | 9,00 | 5 · 10 - 3 | 0,047 | 0,100 | - | 8,24 |
| 5. | 9,90 | 5 · 10 - 4 | 0,050 | 0,010 | - | 7,24 |
| 6. | 9,99 | 5 · 10 - 5 | 0,050 | 0,001 | - | 6,24 |
| 7. | 10,00 | - | 0,050 | - | - | 5,27 |
| 8. | 10,01 | - | 0,050 | - | 5 · 10- 5 | 4,30 |
| 9. | 10,10 | - | 0,050 | - | 5 · 10- 4 | 3,30 |
| 10. | 11,00 | - | 0,047 | - | 5 · 10- 3 | 2,30 |
| 11. | 15,00 | - | 0,040 | - | 0,02 | 1,70 |
При добавлении 9,0 мл 0,1 М HCl концентрация неоттитрованного слабого основания и его соли рассчитывается следующим образом:
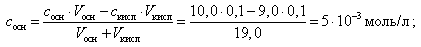 (20)
(20)
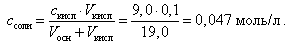 (21)
(21)
Расчет рН буферной смеси ведут по формуле
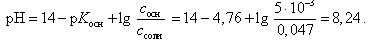 (22)
(22)
Аналогично рассчитывается рН в начале скачка на кривой титрования.
Значение рН в начале скачка на кривой титрования (добавлено 9,99 мл 0,1 М HCl) можно рассчитать с учетом следующих соображений: в растворе останется 0,1 % неоттитрованного одноосновного слабого основания и образуется 99,9 % соли:
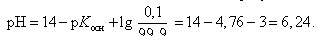
В точке эквивалентности (добавлено 10,0 мл 0,1 М HCl)
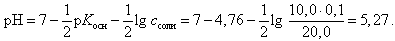 (23)
(23)
За точкой эквивалентности в растворе находится избыток сильной кислоты, следовательно, концентрация [H+]-ионов определяется по формуле (9).
Например, в конце скачка титрования (V(HCl) = 10,01 мл)
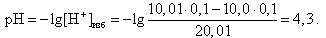
Внешний вид кривой титрования изображен на рис.3.
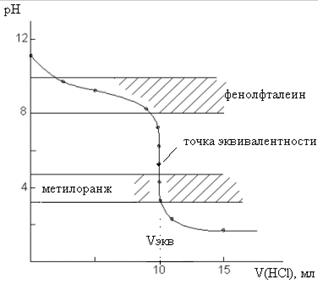
Рис.3. Кривая титрования 10 мл 0,1 М NH4OH раствором 0,1 М HCl
Анализ кривой титрования
При титровании слабого основания сильной кислотой скачок на кривой титрования и точка эквивалентности лежат в кислой среде. В данном случае скачок лежит в интервале от 6,24 до 4,3. ΔрН составляет ~1,9 единиц, т. е. значительно меньше скачка на кривой титрования сильного основания сильной кислотой. В качестве индикатора можно использовать метиловый оранжевый, изменяющий окраску в этой области. Применять фенолфталеин нельзя, так как его интервал перехода окраски не попадает в область скачка не кривой титрования.
Дата добавления: 2015-09-18; просмотров: 13221;
