Восстановитель – е ↔ сопряженный окислитель
Взаимодействие веществ в окислительно-восстановительных реакциях подчиняется закону эквивалентов:
СN(OX)VOX = СN(RED)VRED или nэкв(ox) = nэкв(red),
где СN – нормальная концентрация (моль×экв/л), V – объем (мл или л), nэкв – количество моль эквивалентов (моль×экв).
Эквивалентом окислителя или восстановителя называется его частица (реальная или условная), которая присоединяет или отдает один электрон.
Моль эквивалент – количество вещества, эквивалентное в окислительно-восстановительных реакциях 1 моль электронов.
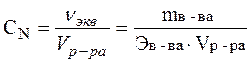 ,
,
или СN = СМ ×z,
где Э – молярная масса эквивалента или эквивалентная масса, которая рассчитывается по формуле: Э = М/z, z – число передаваемых электронов.
Следует различать окислительно-восстановительные эквиваленты веществ от их эквивалентов в реакциях обмена /не сопровождающихся переходом электронов. Так, в реакции 6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 +K2SO4 + 7H2O, эквивалент окислителя ЭK2Cr2O7 = 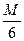 .
.
В то же время в реакции K2Cr2O7 + 2КОН = 2 K2Cr2O4 + Н2О эквивалент K2Cr2O7 = 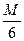 .
.
Дата добавления: 2015-09-18; просмотров: 1237;
