Медленно. В случае вторичных спиртов катион R+ менее устойчив и труднее образуется, что объясняет значительно меньшую скорость замещения
3.  – быстро
– быстро
В случае вторичных спиртов катион R+ менее устойчив и труднее образуется, что объясняет значительно меньшую скорость замещения. Первичные спирты реагируют по-иному, без образования карбениевого иона. Здесь реализуется одностадийный механизм замещения SN2; процесс идет относительно медленно:
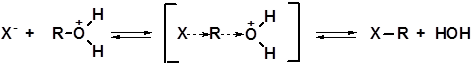
Иллюстрацией приведенных закономерностей может служить взаимодействие галогеноводородов с гераниолом, терпинеолом и цитронеллолом. Гераниол (спирт аллильной структуры) легко превращается в геранилхлорид при пропускании хлороводорода через толуольный раствор гераниола (температура около 100 °С):

гераниол геранилхлорид
Цитронеллол (первичный спирт) в этих условиях не реагирует.
Очень легко замещает гидроксильную группу на галоген третичный спирт терпинеол.
В ряду моноциклических вторичных терпеновых спиртов замещение протекает легче у изомеров, где группа ОН находится на аксиальной связи. Так, неоментол в реакциях замещения значительно активнее, чем ментол. Это соответствует общим закономерностям реакций SN у производных циклогексана.
Интересно сильное различие скоростей замещения ОН-группы у борнеола и изоборнеола. Изоборнеол легко замещает гидроксильную группу на галоген, тогда как борнеол – с большим трудом. Так, взаимодействие изоборнеола с FeCl3 в эфире протекает быстро и приводит к продукту замещения. При использовании борнеола замещения не происходит, и он в условиях реакции окисляется ионом Fe3+ в камфору.
Поскольку процесс по механизму SN1 протекает с образованием карбениевых ионов в качестве интермедиатов, он может сопровождаться перегруппировками, характерными для этих ионов. Так, при взаимодействии линалоола с HCl образуется в основном не линалилхлорид, а геранилхлорид – продукт аллильной перегруппировки:
 линалоол геранилхлорид
линалоол геранилхлорид
Преимущественное образование геранилхлорида связано с большей термодинамической стабильностью этого соединения.
3.3.1.2 Реакции дегидратации. Дегидратация спиртов, т.е. отщепление воды от спирта с образованием алкена, является реакцией, обратной реакции гидратации алкенов, рассмотренной ранее. Дегидратация, как и гидратация, катализируется кислотами. Процесс проводят при нагревании, что увеличивает скорость реакции и способствует смещению равновесия вправо (дегидратация – эндотермический процесс; ΔН>0).
Механизм дегидратации спиртов выглядит следующим образом:
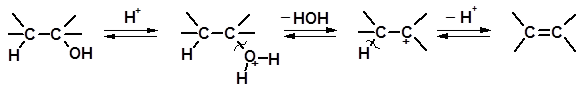
спирт 1алкен
Процесс идет через образование катиона 1 и является примером реакций элиминирования типа Е1. Дегидратация протекает тем быстрее, чем стабильнее карбениевый ион 1. Поэтому легко отщепляют воду третичные спирты и спирты аллильной структуры, значительно труднее – вторичные спирты и наиболее трудно – первичные.
В ходе дегидратации возможны изомеризационные превращения, усложняющие состав, что объясняется склонностью карбениевых ионов к перегруппировкам.
Среди ациклических терпеновых спиртов легко отщепляют воду спирты аллильной структуры – гераниол, нерол, линалоол. Легче всего реагирует линалоол, у которого спиртовая группа связана с третичным атомом углерода. Состав продуктов дегидратации сложен и зависит от условий процесса. Под действием кислоты происходит отщепление воды с образованием сопряженных катионов аллильной структуры, отличающихся пространственным расположением сопряженной системы:

1 2
Катионы 1 и 2 после отщепления протона образуют геометрические изомеры мирцена и оцимена.
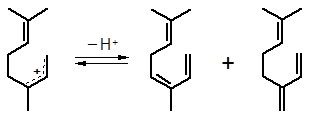
1Z-оцимен E-мирцен
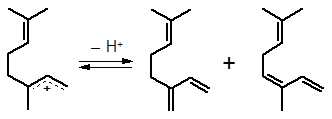
2Z-мирцен E-оцимен
Катион 1 легко циклизуется, что приводит к моноциклическим углеводородам ряда пара-ментана:
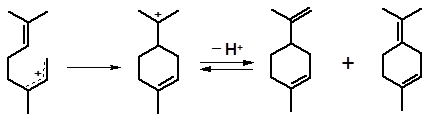
1дипентен терпинолен
Дипентен и терпинолен далее могут изомеризоваться и в другие моноциклические углеводороды (см. 3.1.1).
Процесс циклизации необратим, поэтому при проведении дегидратации в жестких условиях с длительной выдержкой (т.е. с термодинамическим контролем) основными продуктами оказываются дипентен и другие моноциклические углеводороды.
Аналогично идет дегидратация гераниола и нерола, хотя процесс протекает несколько медленнее.
Легко отщепляют воду α-, β-, γ-терпинеолы, терпиненолы (третичные спирты), карвеол (спирт аллильного типа) и другие подобные спирты. Реакция идет количественно и используется в аналитических целях для определения спиртов в составе эфирных масел. Дегидратацию ведут в присутствии серной или толуолсульфокислоты (~ 1 % от массы спирта), в кипящем толуольном растворе (температура кипения 120-130 ºС). Количество воды определяют по объему, отгоняя ее из реакционной массы в виде азеотропа с толуолом, или титрованием с помощью реактива Фишера (раствор I2 и SО2 в пиридине и метаноле).
Вторичные спирты подвергаются дегидратации гораздо труднее. Исключение составляет изоборнеол, который ведет себя как третичный спирт и может быть определен методом дегидратации. Это связано с пространственной структурой изоборнеола. Механизм процесса может быть представлен следующим образом:

изоборнеол 1 2 2 камфен
 Отщепление воды от протонированной молекулы изоборнеола происходит одновременно с перегруппировкой углеродного скелета молекулы (структура камфана переходит в структуру изокамфана). При этом перемещающаяся электронная пара выталкивает молекулу воды сзади, действуя вдоль линии связи , как это происходит в реакциях SN2. В результате перегруппировка облегчает разрыв связи углерод-кислород и одновременно приводит к образованию устойчивого третичного катиона 2, как и при дегидратации третичных спиртов. В этой связи весь процесс дегидратации протекает так же легко, как и у третичных спиртов. Описаны примеры проведения дегидратации изоборнеола в присутствии таких мягких катализаторов, как гидросульфат натрия и уксусная кислота.
Отщепление воды от протонированной молекулы изоборнеола происходит одновременно с перегруппировкой углеродного скелета молекулы (структура камфана переходит в структуру изокамфана). При этом перемещающаяся электронная пара выталкивает молекулу воды сзади, действуя вдоль линии связи , как это происходит в реакциях SN2. В результате перегруппировка облегчает разрыв связи углерод-кислород и одновременно приводит к образованию устойчивого третичного катиона 2, как и при дегидратации третичных спиртов. В этой связи весь процесс дегидратации протекает так же легко, как и у третичных спиртов. Описаны примеры проведения дегидратации изоборнеола в присутствии таких мягких катализаторов, как гидросульфат натрия и уксусная кислота.
 В случае борнеола, у которого пространственное положение гидроксильной группы иное, синхронное отщепление воды и перегруппировка невозможны, так как перемещающаяся электронная пара и связь не могут оказаться на одной линии, и процесс по типу SN2 невозможен. Реакция идет ступенчато через трудно образующийся вторичный карбениевый ион 3 и поэтому медленно:
В случае борнеола, у которого пространственное положение гидроксильной группы иное, синхронное отщепление воды и перегруппировка невозможны, так как перемещающаяся электронная пара и связь не могут оказаться на одной линии, и процесс по типу SN2 невозможен. Реакция идет ступенчато через трудно образующийся вторичный карбениевый ион 3 и поэтому медленно:

- медленно
Катион 3 быстро перегруппировывается в более стабильную структуру 2 и конечным продуктом дегидратации изоборнеола также оказывается камфен:
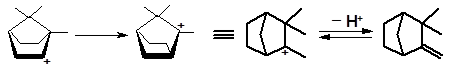
3 2 2 камфен
Дегидратация борнеола наблюдается лишь в жестких условиях - при нагревании с серной кислотой концентрацией 50 % и выше.
Первичные спирты – цитронеллол, лавандулол – к дегидратации весьма устойчивы.

Дата добавления: 2015-09-29; просмотров: 1070;
