КОНТРОЛЬНЫЕ ЗАДАНИЯ. 151. Как изменится скорость реакции образования аммиака N2 + 3H2 D 2NH3, если а) увеличить давление в системе в два раза и б) увеличить объем газовой смеси в
151. Как изменится скорость реакции образования аммиака N2 + 3H2 D 2NH3, если а) увеличить давление в системе в два раза и б) увеличить объем газовой смеси в три раза? Ответ: а) в 16 раз; б) в 81 раз
152. Вычислите температурный коэффициент скорости реакции, зная, что с повышением температуры на 60 °С скорость возрастает в 128 раз. Ответ: 6
153. Окисление аммиака идет по уравнению 4NH3 + 5O2 D 4NO + 6H2O. Через некоторое время концентрации веществ были равны следующим значения (моль/л): [NH3]t = 0,009; [O2]t = 0,002; [NO]t = 0,003. Вычислите концентрацию водяного пара в этот момент и исходные концентрации аммиака и кислорода. Ответ: D[H2O] = 0,0045 моль/л; [NH3]исх. = 0,012 моль/; [O2]исх. = 0,0238 моль/л.
154. Равновесие системы 2SO2 + O2 D 2SO3 установилось, когда концентрации компонентов (моль/л) были: [SO2]равн. = 0,6; [O2]равн. = 0,24; [SO3]равн. = 0,21. Вычислите константу равновесия этой реакции и исходные концентрации кислорода и диоксида серы. Ответ: К= 0,51; [SO2]исх = 0,81 моль/л; [O2]исх. = [O2]равн. + [O2]изр. = 0,24 + 0,105 = 0,345 моль/л.
155. В каком направлении сместится равновесие в реакциях при повышении температуры, понижении давления и увеличении концентрации водорода? а) CO(г) + H2O(г) D CO2(г) + H2(г), DH0 = -41,84 кДж; N2(г) + 3H2(г) D 2NH3(г), DH0 = 92,40 кДж; H2(г) + S(тв) D H2S(г), DH0 = -20,50 кДж
156. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г) 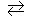 2SO3(г) если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Ответ: прямой увеличилась в 27 раз, обратной в 9 раз.
2SO3(г) если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Ответ: прямой увеличилась в 27 раз, обратной в 9 раз.
157. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2. Ответ: в 16 раз.
158. Константа равновесия гомогенной системы: СО(г) + Н2О(г) 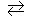 СО2(г) + Н2(г) при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л. Ответ: [СО2]р = 1,2 моль/л; [Н2]р= 1,2 моль/л; [СО]р = 1,8 моль/л; [Н2О]р =0,8 моль/л.
СО2(г) + Н2(г) при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л. Ответ: [СО2]р = 1,2 моль/л; [Н2]р= 1,2 моль/л; [СО]р = 1,8 моль/л; [Н2О]р =0,8 моль/л.
159. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению: PCl5(г) 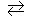 РСl3(г) + Сl(г); DН = + 92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5?
РСl3(г) + Сl(г); DН = + 92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5?
160. Как изменится скорость реакции 2NO(г) + O2(г)= 2NO2(г), если общее давление в системе уменьшить в 5 раз? Ответ: Увеличилась в 125 раз
161. В какую сторону сместится равновесие в реакции: CO2 (г) + C (тв) = 2 CO (г); DH° > 0 а) при повышении температуры; б) при увеличении давления? Напишите выражение для константы равновесия.
162. Реакция в газовой фазе протекает по уравнению: А + В « 2С. Определить равновесные концентрации реагирующих веществ, если исходные концентрации (моль/л): [А] = 4; [В] = 6; константа равновесия К = 1. Ответ: [А] = 2,1 моль/л; [В] = 4,1 моль/л; [С] = 3,8 моль/л.
163. Константа скорости реакции при 283 К равна 1,08.10–4, а при 333 К равна 5,484.10–2. Вычислить энергию активации и константу скорости реакции при 303 К. Ответ: ЕА = 97600 кДж/моль; К303 = 1,67 * 10-3
164. Написать выражения закона действия масс для реакций: а) 2NO(г) + Cl2(г) = 2NOCl(г); б) СаСО3(к) = СаО(к) + СО2(г). Как изменится скорость реакции 2NO(г) + О2(г) = 2NO2(г), если уменьшить объем реакционной смеси в три раза? Ответ: возрастет в 27 раз.
165. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастает скорость реакции при повышении температуры от 20 до 75 0С? Ответ: увеличится в 287 раз.
166. В системе А(г) + 2В(г) = С(г) равновесные концентрации равны: [А] = 0,06 моль/л, [В] = 0,12 моль/л, [С] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В. Ответ: К = 2,5; [А0] = 0,276 моль/л; [В0] = 0,552 моль/л.
167. Как изменится скорость реакции 2NO(г.)+O2(г.)→2NO2(г.) если уменьшить объём реакционного сосуда в 3 раза? Ответ: возросла в 27 раз.
168. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастёт скорость реакции при повышении температуры от 20 до 75 0С? Ответ: в 287 раз.
169. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, а с катализатором – 50,14 кДж/моль. Во сколько раз возрастёт скорость реакции в присутствии катализатора, если реакция протекает при 298 К. Ответ: возросла в 25 тысяч раз.
170. При некоторой температуре константа диссоциации йодовродорода на простые вещества равна 6,25·10-2. Какой процент HI диссоциирует при этой температуре? Ответ: 33,3%
171. В каком направлении сместится равновесие в системах а) СО(г.)+Сl2(г.)↔СОСl2(г.) б) 2HI(г.)↔H2(г.)+I2(г.), если при неизменной температуре увеличить давление газовой смеси.
172. Используя справочные данные, найти значение температуры, при которой константа равновесия реакции образования водяного газа равна единице. С(графит) + Н2О(г.) ↔ СО(г.) + Н2(г.). Ответ: 983 К.
173. Реакция идет по уравнению СО(г) + Н2О(г) = СО2(г) + Н2(г). Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]0= 3моль/л, [H2O]0 = 2моль/л. Ответ: [CO2] =1,2 моль/л; [H2] =1,2 моль/л; [CO] = 1,8 моль/л; [H2O] = 0,8 моль/л.
174. При некоторых условиях равновесие реакции СО+Н2О ↔ Н2 +СО2 установилось при следующих концентрациях: [СО]г=1 моль/л; [Н2О]г =4 моль/л; [Н2]г=2 моль/л; [СО2]г =2 моль/л. В какую сторону сместится равновесие при повышении концентрации СО в 3 раза? При какой концентрации установится новое равновесие? Ответ: [СО] =2,27 моль/л; [Н2О] = 3,27 моль/л; [СО2] = 2.73 моль/л; [Н2] = 2.73 моль/л
175. В каком направлении сместится равновесие в системе при понижении температуры и уменьшении объема: CO2 + C(Т) = 2 CO – Q. Ответ обосновать.
176. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости этой реакции при 5080С равна 0,16. Исходные концентрации реагирующих веществ были: [Н2] = 0,04 моль/л; [I2] = 0,05 моль/л. Вычислите начальную скорость реакции и скорость ее, когда [Н2] стала равной 0,03 моль/л. Ответ: V0 = 320 * 10-6 ; V = 182 * 10-6
177. Напишите выражение для константы равновесия гомогенной системы: N2 + H2 ↔.2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в 3 раза? Ответ: увеличится в 9 раз
178. Как изменится равновесие в системе при повышении температуры и давления в газовой смеси: PCl5 (Г) ↔ PCl3 (Г)+ Cl2(Г), ∆Н = 92,6? Ответ обосновать.
179. Как изменится скорость реакции 2NO(г) + O2(г) → 2NO2(г), если увеличить давление в системе в 3 раза? Ответ: увеличится в 27 раз
180. Реакция идет по уравнению N2 + 3H2 ↔.2NH3. Концентрации участвующих в ней веществ были [N2]0 = 0,8 моль/л, [H2]0 = 1,5 моль/л, [NH3]0 = 0,1 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л. Ответ: [Н2] = 0,6 моль/л; [NH3] = 0,7 моль/л
Дата добавления: 2015-09-29; просмотров: 2423;
