Свойства растворов. Температура кипения и замерзания растворов.
Концентрацией раствораназывается содержание растворенного вещества в определенной массе или объеме раствора или растворителя. Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными - концентрациями.
Концентрацию веществ в растворах можно выразить разными способами. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества ώ – это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
ώ = mв-ва / mр-ра . 100%
Массовую долю растворённого вещества ώ (B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Молярная концентрация Cм показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
Cм = nв-ва / V = mв-ва / Mв-ва · V,
где Мв-ва - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г MNaOH = 40 г/моль).
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Cн = mв-ва / Эв-ва · V,
где, Эв-ва – эквивалент растворенного вещества г
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования= Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
Например:
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г
Пример 1.Вычислите: а) процентную (С%); б) молярную (СМ); в) эквивалентную (СН); г) моляльную (Сm) концентрации раствора H3PO4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3 . Чему равен титр Т этого раствора?
Решение. а) массовая процентная концентрация показывает число граммов (единиц массы) раствора. Так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 +282 = 300 г и , следовательно,
300 – 18
100 – С% С% = 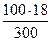 = 6%
= 6%
б) мольно-объемная концентрация или молярность , показывает число молей растворенного вещества, содержащихся в 1л раствора. Масса 1л раствора 1031г. Массу кислоты в литре раствора находим из соотношения
300 – 18
1031 – Х Х = 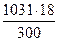 = 61,86
= 61,86
Молярность раствора получим делением числа граммов H3PO4 в 1л раствора на мольную массу H3PO4 (97,99 г/моль).
СМ = 61,86 / 97,99 = 0,63 М
в) эквивалентная концентрация или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1л раствора. Так как эквивалентная масса
H3PO4 = 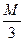 =
= 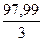 = 32,66 г/моль, то СН = 61,86 / 32,66 = 1,89н;
= 32,66 г/моль, то СН = 61,86 / 32,66 = 1,89н;
г) мольно-массовая концентрация или моляльность, показывает число молей растворенного вещества, содержащихся в 1000г растворителя. Массу H3PO4 в 1000г растворителя находим из соотношения
282 – 18
1000 – Х Х = 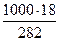 = 68,83
= 68,83
Отсюда Сm = 68,83 / 97,99 = 0,65m
Титром раствора называется число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1л раствора содержится 61,86 кислоты, то
Т = 61,86 / 1000 = 0,06186 1г/см3
Зная нормальность раствора и эквивалентную массу (mЭ) растворенного вещества, титр легко найти по формуле
Т = СНmЭ / 1000.
Пример 2.На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5н раствора щелочи. Чему равна нормальность кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
V1/ V2 = СН2 / СН1 или V1СН1 = V2СН2
50 * СН1 = 25 * 0,5, откуда СН1= 25 * 0,5 / 50 = 0,25н
Пример 3.К метиловому спирту массой 32г и плотностью 0,8 г/мл добавили воду до объема 80 мл. Определите объемную долю спирта в растворе.
Решение. Рассчитаем объем растворенного вещества:
V(спирт) = 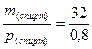 =40 мл
=40 мл
Определяем объемную долю спирта в растворе по соотношению
V(спирт) = 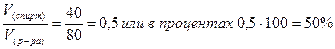 =40 мл
=40 мл
Пример 4. Найти массы воды и медного купороса CuSO4 · 5Н2О, необходимые для приготовления одного литра раствора, содержащего 8% (масс) безводной соли. Плотность 8% раствора CuSO4 равна 1,084 г/мл.
Решение. Масса 1 л полученного раствора будет составлять 1,084 * 1000 = 1084г. В этом растворе должно содержаться 8% безводной соли, т.е. 1084 * 0,08 = 86,7г. Массу CuSO4 * 5Н2О (мольная масса 249,7 г/моль), содержащую 86,7г безводной соли (мольная масса 159,6 г/моль), найдем из пропорции 249,7 : 159,6 = Х : 86,7.
Х = 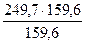 = 135,6
= 135,6
Необходимая для приготовления раствора масса воды составит 1084 – 135,6 = 948,4г.
Пример 5. К 1л 10% - ного раствора КОН (пл. 1,092 г/ см3) прибавили 0,5л 5% - ного раствора КОН (пл. 1,045 г/ см3). Объем смеси довели до 2л. Вычислить молярную концентрацию полученного раствора.
Решение. Масса 1л 10% - ного раствора КОН 1092 г. В этом растворе содержится 1092 * 10 / 100 = 109,2 г КОН. Масса 0,5л 5% - ного раствора 1045 * 0,5 = 522,5г. В этом растворе содержится 522,5 * 5 / 100 = 26,125г КОН.
В общем объеме полученного раствора (2л) содержимое КОН составляет 109,2 + 26,125 = 135,325г. Отсюда молярность этого раствора СМ = 135,235 / 256,1 = 1,2М, где 56,1 г/моль – мольная масса КОН.
Пример 6.Какой объем 96% - й кислоты плотностью 1,8 г/см3 потребуется для приготовления 3л 0,4 н раствора?
Решение. Эквивалентная масса
Н2SO4 = 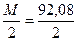 = 49,04 г/моль
= 49,04 г/моль
Для приготовления 3л 0,4 н раствора требуется 49,04 · 0,4 · 3 = 58,848 г Н2SO4 . Масса 1см3 96% - ной кислоты 1,84 г. В этом растворе содержится 1,84 * 96 / 100 = 1,766 г Н2SO4 . Следовательно, для приготовления 3л 0,4 н раствора надо взять 58,848 : 1,766 = 38,32 см3 этой кислоты.
Закон эквивалентов:Все вещества реагируют между собой в эквивалентных количествах.
Иногда удобнее пользоваться другим определением закона эквивалентов: массы (объемы) реагирующих между собой веществ пропорциональны их молярным массам эквивалентов (объемам эквивалентов).
m1 / m2 = Э1 / Э2 – формула для веществ
Сн1 х V1 = Сн2 х V2 – формула для растворов
Титр –масса растворенного вещества в 1 мл раствора T = mв-ва / V
Пример 7.На нейтрализацию 31 см3 0,16 н раствора щелочи требуется 217 см3 раствора H2SO4. Чему равна нормальность и титр раствора H2SO4?
Дата добавления: 2015-09-29; просмотров: 1193;
