Решение. Vщ = 31 см3 по з-ну эквивалентов: Снщ * Vщ = Снк * Vк
Дано:
Vщ = 31 см3 по з-ну эквивалентов: Снщ * Vщ = Снк * Vк
Снщ = 0,16 н Снк = Снщ * Vщ / Vк, отсюда
Vк = 217 см3 Снк = 0,16н 31 см3 / 217 см3 = 0,02н
Снк = ? Снк = mк / Эк * V; mк = Снк * Эк х V
титр -? Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г/моль
mк = 0,02 * 49 * 1л = 0,98 г
T = mк / V; Т = 0,098 / 1000 мл = 0,00098 г/мл
Ответ: Снк = 0,02 н; титр = 0,00098 г/мл
Температуры кристаллизации, замерзания и кипения растворов:
Раствор кипит при более высокой и замерзает при более низкой температуре, чем растворитель. Повышение температуры кипения и понижение температуры замерзания растворов прямо пропорционально их моляльной концентрации:
∆t0кип = ЕСm; ∆t0зам = КСm,
где
∆t0кип - повышение температуры кипения;
∆t0зам - понижение температуры замерзания;
Е - эбуллиоскопическая константа;
К - криоскопическая константа;
Сm - моляльная концентрация раствора.
Сm = 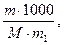
где m - масса растворенного вещества в 1000 г растворителя;
M - молекулярная масса растворенного вещества;
m1 - масса растворителя.
Подставив Сm в уравнение (I), получим:
∆t0кип = Е 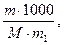 ∆t0зам = К
∆t0зам = К 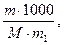
Зная t0кип или t0зам можно найти молекулярную массу растворенного вещества (М), эбуллиоскопическую (Е) или криоскопическую (К) константы.
Например. Определить температуру кипения 10% - го растворы глюкозы в воде. Е 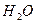 = 0,520.
= 0,520.
Решение. В 10% - ом растворе глюкозы в 100г раствора содержится 10г глюкозы и 90 г растворителя. Подставив конкретные значения:
Е 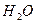 = 0,520, m = 10г; m1 = 90г
= 0,520, m = 10г; m1 = 90г
М 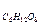 = 180 в уравнение (II) , получим
= 180 в уравнение (II) , получим
t0кип = 0,52  = 0,3200
= 0,3200
Вода кипит при р = 760 мм.рт.ст. при 1000С, поэтому температура кипения раствора равна 100 + 0,32 = 100,320С.
Дата добавления: 2015-09-29; просмотров: 817;
