Классификация. Различают четыре типа окислительно-восстановительных реакций.
1. Если окислитель и восстановитель – разные вещества, то такие реакции относят к межмолекулярным. Примерами таких процессов служат все рассмотренные ранее реакции.
2. При термическом разложении сложных соединений, в состав которых входят окислитель и восстановитель в виде атомов разных элементов, происходят окислительно-восстановительные реакции, называемые внутримолекулярными: ( 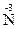 H4)2
H4)2 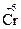 2O7
2O7 
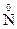 2 +
2 + 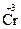 2O3 + 4H2O
2O3 + 4H2O
3. Реакции диспропорционированиямогут происходить, если соединения, содержащие элементы в промежуточных степенях окисления, попадают в условия, где они оказываются неустойчивыми (например, при повышенной температуре). Степень окисления этого элемента и повышается и понижается: 2Н2 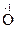 2
2 
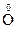 2 + 2Н2
2 + 2Н2 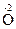
4. Реакции контрпропорционирования – это процессы взаимодействия окислителя и восстановителя, в состав которых входит один и тот же элемент в разных степенях окисления. В результате продуктом окисления и продуктом восстановления является вещество с промежуточной степенью окисления атомов данного элемента: Na2 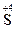 O3 + 2Na2
O3 + 2Na2 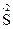 + 6HCl = 3
+ 6HCl = 3 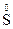 + 6NaCl + 3H2O
+ 6NaCl + 3H2O
5. Существуют также реакции смешанного типа. Например, к внутримолекулярной реакции контрпропорционирования относится реакция разложения нитрата аммония: 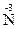 H4
H4 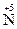 O3
O3 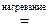
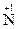 2O + 2H2O
2O + 2H2O
Составление уравнений.Для составления уравнений окислительно-восстановительных реакций наиболее часто используют метод электронно-ионных полуреакций и метод электронного баланса. Метод электронно-ионных полуреакций применяют при составлении уравнений реакций, протекающих в водном растворе, а также реакций с участием веществ, в которых трудно определить степени окисления элементов (например, KNСS, CH3CH2OH). Согласно этому методу выделяют следующие главные этапы составления уравнения реакций:
1. Записывают общую молекулярную схему процесса с указанием восстановителя, окислителя и среды, в которой протекает реакция (кислотная, нейтральная или щелочная). Например:
SO2 + K2Cr2O7 + H2SO4(разб) ® ...
2. Учитывая диссоциацию электролитов в водном растворе, данную схему представляют в виде молекулярно-ионного взаимодействия. Ионы, степени окисления атомов которых не изменяются, в схеме не указывают, за исключением ионов Н+ и ОН-:
SO2 + Cr2O72– + H+ ® ...
3. Определяют степени окисления восстановителя и окислителя, а также продуктов их взаимодействия:
| Окисление восстановителя | Восстановление окислителя |
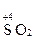 ® ® 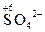
| 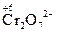 ® 2Cr3+ ® 2Cr3+
|
4. Записывают материальный баланс полуреакции окисления и восстановления:
| Окисление восстановителя | Восстановление окислителя |
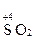 + 2H2O – 2e = + 2H2O – 2e = 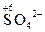 + 4H+ + 4H+
| 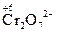 + 14H+ + 6e = 2Cr3+ + 7H2O + 14H+ + 6e = 2Cr3+ + 7H2O
|
5. Суммируют полуреакции, учитывая принцип равенства отданных и принятых электронов:
3∙ôSO2 + 2H2O – 2e = 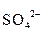 + 4H+
+ 4H+
1∙ô 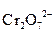 + 14H+ + 6e = 2Cr3+ + 7H2О
+ 14H+ + 6e = 2Cr3+ + 7H2О
3 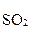 + 6H2O +
+ 6H2O + 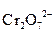 + 14H+ = 3
+ 14H+ = 3 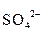 + 12H+ + 2Cr3+ + 7H2О
+ 12H+ + 2Cr3+ + 7H2О
и, сокращая одноименные частицы, получают общее ионно-молекулярное уравнение:
3 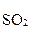 +
+ 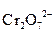 + 2H+ = 3
+ 2H+ = 3 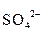 + 2Cr3+ + H2О.
+ 2Cr3+ + H2О.
6. Добавляют ионы, не участвовавшие в процессе окисления-восстановления, уравнивают их количества слева и справа, и записывают молекулярное уравнение реакции:
3SO2 + K2Cr2O7 + H2SO4 (разб) = Cr2(SO4)3 + K2SO4 + H2O.
При составлении материального баланса полуреакций окисления и восстановления, когда изменяется число атомов кислорода, входящих в состав частиц окислителя и восстановителя, следует учитывать, что в водных растворах связывание или присоединение кислорода происходит с участием молекул воды и ионов среды.
В процессе окисления на один атом кислорода, присоединяющийся к частице восстановителя, в кислотной и нейтральной средах расходуется одна молекула воды и образуются два иона Н+; в щелочной среде расходуются два гидроксид-иона ОН- и образуется одна молекула воды (табл.8.1).
Таблица 8.1.Присоединение атомов кислорода к восстановителю в процессе окисления
| Среда | Частицы, участвующие в присоединении одного атома кислорода | Образующиеся частицы | Примеры полуреакций окисления |
| Кислотная, нейтральная | Н2О | 2Н+ | SO32– + H2O – 2e = SO42– + 2H+ SO2 + 2H2O – 2e = SO42– + 4H+ |
| Щелочная | 2ОН- | Н2О | SO32– + 2OH- – 2e = SO42– + H2O SO2 + 4OH- – 2e = SO42– + 2H2O |
В процессе восстановления для связывания одного атома кислорода частицы окислителя в кислотной среде расходуются два иона Н+ и образуется одна молекула воды; в нейтральной и щелочной средах расходуется одна молекула Н2О и образуются два иона ОН- (табл.1.2).
Таблица 8.2. Связывание атомов кислорода окислителя в процессе восстановления
| Среда | Частицы, участвующие в связывании одного атома кислорода | Образующиеся частицы | Примеры полуреакций восстановления |
| Кислотная | 2Н+ | Н2О | 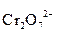 + 14H+ + 6e = 2Cr3+ + 7H2О
MnO4- + 8H+ +5e = Mn2+ + 4H2O + 14H+ + 6e = 2Cr3+ + 7H2О
MnO4- + 8H+ +5e = Mn2+ + 4H2O
|
| Нейтральная, щелочная | Н2О | 2ОН- | CrO42-+4H2O +3e =[Cr(OH)6]3- + 2ОН- MnO4- +3H2O+3e = MnO(OH)2 + 4OH- |
Метод электронного баланса обычно используют для составления уравнений окислительно-восстановительных реакций, протекающих между газами, твердыми веществами и в расплавах. Последовательность операций следующая:
1. Записывают формулы реагентов и продуктов реакции в молекулярном виде:
FeCl3 + H2S ® FeCl2 + S + HCl;
2. Определяют степени окисления атомов, меняющих ее в процессе реакции:
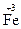 Cl3 + H2
Cl3 + H2 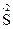 ®
® 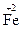 Cl2 +
Cl2 + 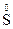 + HCl;
+ HCl;
3. По изменению степеней окисления устанавливают число электронов, отдаваемых восстановителем, и число электронов, принимаемых окислителем, и составляют электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов: 2∙½ 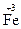 +1e =
+1e = 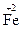
1∙½ 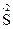 – 2e =
– 2e = 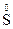
4. Множители электронного баланса записывают в уравнение окислительно-восстановительной реакции как основные стехиометрические коэффициенты: 2FeCl3 + H2S ® 2FeCl2 + S + HCl
5. Подбирают стехиометрические коэффициенты остальных участников реакции: 2FeCl3 + H2S = 2FeCl2 + S + 2HCl.
6. При составлении уравнений следует учитывать, что окислитель (или восстановитель) могут расходоваться не только в основной окислительно-восстановительной реакции, но и при связывании образующихся продуктов реакции, т.е. выступать в роли среды и солеобразователя. Примером, когда роль среды играет окислитель, служит реакция окисления металла в азотной кислоте, составленная методом электронно-ионных полуреакций:
Cu + HNO3(разб) ®...
Cu + NO3- + H+ ® ...
3∙½Cu – 2e= Cu2+
2∙½NO3- + 4H+ + 3e = NO + 2H2O
3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO + 4H2O
3Cu + 2HNO3(окислитель) + 6HNO3(среда) = 3Cu(NO3)2 + 2NO + 4H2O
или 3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4H2O.
Примером, когда восстановитель является средой, в которой протекает реакция, служит реакция окисления соляной кислоты дихроматом калия, составленная методом электронного баланса:
HCl + K2Cr2O7 ® CrCl3 + Cl2 + KCl + H2O
H 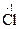 + K2
+ K2 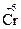 2O7 + HCl ®
2O7 + HCl ® 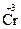 Cl3 +
Cl3 + 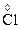 2 + KCl + H2O
2 + KCl + H2O
6∙½ 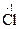 – 1e =
– 1e = 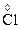
2∙½ 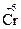 + 3e =
+ 3e = 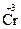
6 HCl(восстановитель) + K2Cr2O7 + HCl(среда) ® 2CrCl3 + 3Cl2 + KCl + H2O
6 HCl + K2Cr2O7 + 8HCl = 2CrCl3 + 3Cl2 +2 KCl + 7H2O
или 4HCl + K2Cr2O7 = 2CrCl3 + 3Cl2 +2 KCl + 7H2O
При расчете количественных, массовых и объемных соотношений участников окислительно-восстановительных реакций, используют основные стехиометрические законы химии, и, в частности, закон эквивалентов, учитывая, что число эквивалентности окислителя равно числу электронов, которые принимает одна формульная единица окислителя, а число эквивалентности восстановителя равно числу электронов, которые отдает одна формульная единица восстановителя.
Окисление-восстановление – это единый взаимосвязанный процесс. Атом элемента в своей высшей степени окисленности не может ее повысить (отдавать электроны) и проявляет только окислительные свойства, а в своей низшей степени окисленности не может ее понизить (принять электроны) и проявляет только восстановительные свойства. Атом же элемента, имеющий промежуточную степень окисленности, может проявлять как окислительные, так и восстановительные свойства.
Например:
N5+(HNO3) проявляет только окислительные свойства;
N4+(NO2) проявляет окислительные и восстановительные свойства;
N3+(HNO2) проявляет окислительные и восстановительные свойства;
N2+(NO) проявляет окислительные и восстановительные свойства;
N1+(N2O) проявляет окислительные и восстановительные свойства;
N0(N2) проявляет окислительные и восстановительные свойства;
N1-(NH2OH) проявляет окислительные и восстановительные свойства;
N2-(N2H2) проявляет окислительные и восстановительные свойства;
N3-(NH3) проявляет только восстановительные свойства.
Пример 1. Исходя из степени окисленности (n) азота, серы и марганца в соединениях NH3 HNO2 HNO3 H2S H2SO3 H2SO4 MnO2 KMnO4, определите какие из них могут быть только восстановителями, только окислителями, и какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисленности для азота в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n для серы соответственно равна –2 (низшая), +4 (промежуточная), +6 (высшая); n для марганца соответственно равна +4 (промежуточная), +7 (высшая). Отсюда: NH3, H2S – только восстановители; HNO3, H2SO4, KMnO4 – только окислители; HNO2, H2SO3, MnO2 – окислители и восстановители.
Пример 2. Составьте уравнение окислительно-восстановительной реакции идущей по схеме
+3 +7 +2 +5
H3PO3+KMnO4+H2SO4=MnSO4+H3PO4+K2SO4+H2O
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяет свою степень окисленности восстановитель и окислитель, и отражаем это в электронных уравнениях:
 восстановитель 5 P3+ - 2e- = P5+ - процесс окисления
восстановитель 5 P3+ - 2e- = P5+ - процесс окисления
окислитель 2 Mn7+ + 5e- = Mn2+ - процесс восстановления
Общее число электронов отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя, а при делении 10 на 2 получаем коэффициент 5 для восстановителя. Коэффициент перед веществами, атомы которых не меняют свою степень окисленности, находят подбором. Уравнение реакции будет иметь вид:
5H3PO3+2KMnO4+3H2SO4=2MnSO4+5H3PO4+K2SO4+3H2O
Пример 3. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Решение. Цинк, как и любой металл, проявляет только восстановительные свойства.
В концентрированной серной кислоте окислительную функцию несет сера (+6). Максимальное восстановление серы означает, что приобретает минимальную степень окисленности. Минимальная степень окисленности серы как элемента VI группы равна –2. Цинк как металл II группы имеет постоянную степень окисленности +2. Поэтому электронные уравнения будут иметь вид:
 восстановитель 4 Zn0 - 2e- = Zn2+ - процесс окисления
восстановитель 4 Zn0 - 2e- = Zn2+ - процесс окисления
окислитель 1 S6+ + 8e- = S2- - процесс восстановления
Составляем уравнение реакции:
4Zn+5H2SO4=4ZnSO4+H2S+4H2O
Перед H2SO4 стоит коэффициент 5, а не 1, так как четыре молекулы H2SO4 идут на связывание четырех ионов Zn2+.
Пример 5. Определите типы окислительно-восстановительных реакций для следующих процессов:
а) H2S+ HNO3= H2SO4+ NO2+ H2O
б) H3PO3= H3PO4+ PH3
в) (NH4)2Cr2O7=N2+ Cr2O3+ H2O
Дата добавления: 2015-09-29; просмотров: 1349;
