КОНТРОЛЬНЫЕ ЗАДАНИЯ. 211. Какие из приведенных реакций являются окислительно-восстановительными?
211. Какие из приведенных реакций являются окислительно-восстановительными? Укажите для каждой из них окислитель и восстановитель. а)Fe + 2HCl = FeCl2 + H2; б) FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl; в) Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3; г) 2KI + Cl2 = 2KCl + I2
212. Какой процесс окисления или восстановления происходит при следующих превращениях: 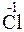
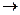
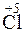 ;
; 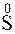
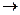
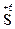 ;
; 
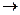
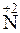 ;
; 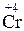
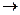
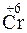 ;
; 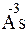
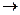
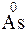 ;
; 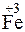
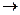
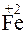 ?
?
213. Реакция выражается схемами: а) KClO3 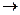 KClO4 + KCl; б) (NH4)2S + K2Cr2O7 + H2O
KClO4 + KCl; б) (NH4)2S + K2Cr2O7 + H2O 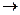 S + Cr(OH)3 + NH3 + KOH. Составьте электронные уравнения, расставьте коэффициенты, укажите окислитель и восстановитель.
S + Cr(OH)3 + NH3 + KOH. Составьте электронные уравнения, расставьте коэффициенты, укажите окислитель и восстановитель.
214. Диоксид азота при растворении в воде образует смесь двух кислот. Напишите уравнение реакции и составьте уравнения электронного баланса.
215. Рассмотрите восстановительную способность щелочных металлов на примере взаимодействия лития с кислородом, водородом, хлором, серой, азотом, углеродом и водой.
216. Почему пероксид водорода может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений напишите реакции взаимодействия пероксида водорода с диоксидом свинца в азотнокислой среде, с сульфидом свинца в нейтральной среде.
217. Допишите уравнения реакций: а) Na2O2 + KI + H2SO4 ® …; б) Na2O2 + Fe(OH)2 + H2O ® …; в) Na2O2 + KMnO4 + H2SO4 ® …; г) Na2O2 + H2O ® …; д) Na2O2 + H2SO4 ®… Окислителем или восстановителем является пероксид натрия в этих реакциях?
218. Напишите реакции получения нитрида и гидроксида бария и разложения их водой. К окислительно-восстановительным реакциям составьте электронные уравнения.
219. Почему хлор способен к реакциям самоокисления-самовосстановления (диспропорционирования)? На основании электронных уравнений напишите реакцию растворения хлора в едком натре.
220. На основании электронных уравнений составьте уравнение реакции взаимодействия серы с азотной кислотой, учитывая, что сера окисляется максимально, а азот восстанавливается минимально.
221. Напишите формулы и назовите оксиды азота, укажите степени окисления азота в каждом из них. Какой из этих оксидов более сильный окислитель? На основании электронных уравнений закончите уравнение реакции, учитывая, что азот приобретает минимальную степень окисления: KNO2 + Al + KOH + H2O = KAlO2 + …
222. Какие степени окисления проявляет марганец в соединениях? Составьте формулы оксидов марганца, отвечающих этим степеням окисления. Как меняются кислотно-основные свойства оксидов марганца при переходе от низшей к высшей степени окисления? Составьте уравнения реакций взаимодействия оксида марганца (II) с серной кислотой и оксида марганца(III) с гидроксидом калия.
223. Составьте электронные и молекулярные уравнения реакций растворения золота в царской водке и взаимодействия вольфрама с хлором. Золото окисляется до степени окисления (+3), а вольфрам - до максимальной.
224. Через подкисленный серной кислотой раствор дихромата калия пропустили газообразный сероводород. Через некоторое время оранжевая окраска перешла в зеленую и одновременно жидкость стала мутной. Составьте молекулярное и электронное уравнения происходящей реакции, учитывая минимальное окисление сероводорода.
225. Расставьте коэффициенты методом электронного баланса в следующем уравнении: NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O.
226. Составить уравнение реакции сульфида мышьяка (III) As2S3 с концентрированной азотной кислотой по схеме: A2S2 + NO3– → AsO43– + SO42– + NO2 + H2O.
227. Сколько граммов FeSO4 можно окислить в присутствии H2SO4 с помощью 100 мл 0,25 н. раствора K2CrO4?
228. Соединения меди, серебра и золота хорошие окислители. Почему? Составьте электронные и молекулярные уравнения реакций: а) CuO + NH4Cl → N2 + …; б) Ag2O + Cr(OH)3 + NaOH → …; в) Au2O3 + H2O2 →…
229. Подберите коэффициенты методом электронно-ионного баланса в уравнении окислительно-восстановительной реакции: KMnO4 + H2SO4 + Na2SO3 → MnSO4 + H2O + Na2SO4 + …
230. Подберите коэффициенты методом электронно-ионного баланса в уравнении окислительно-восстановительной реакции: Na2SO3 + KOH + KMnO4 → Na2SO4 + H2O + K2MnO4
231. Подберите коэффициенты в уравнении реакции, протекающей в нейтральной среде: KMnO4 + H2О + Na2SO3 → MnО2(т) + Na2SO4 + …
232. Подберите коэффициенты в уравнении реакции, протекающей в слабокислотной среде: KMnO4 + H2SO4 + Na2SO3 → MnО2(т) + H2O + Na2SO4 + …
233. Напишите уравнение реакции окисления дисульфида железа (II) концентрированной азотной кислотой. Составьте: схемы электронного и электронно-ионного баланса.
234. Напишите уравнения реакций, протекающих в водной среде: а) Na2SО3 + КМnО4 + Н2SО4 → X + …; б) Х + КОН → ...
235. Могут ли проходить окислительно-восстановительные реакции между следующими веществами: а) H2S и HI; б) H2S и H2SO3; в) H2SO3 и HClO4?
236. Определите типы окислительно-восстановительных реакций для следующих процессов: а) H2S+ HNO3= H2SO4+ NO2+ H2O; б) H3PO3= H3PO4+ PH3; в) (NH4)2Cr2O7=N2+ Cr2O3+ H2O
237. Какие из указанных ниже соединений могут проявлять только окислительные свойства: CrSO4 ; K2CrO4 ; NaCrO2. Ответ обосновать.
238. Укажите, какие из приведенных процессов являются процессами окисления: а) SO2 → S2– ; б) ClO– → Cl– ; в) CrO2– → CrO42–
239. Укажите, какие из реакций являются окислительно-восстановительными: а) 2Al + Cr2O3 → Al2O3 + 2Cr; б) Al2(SO4)3 + 6 NaOH → 2Al(OH)3 + 3Na2SO4 ; в) Al(OH)3 + NaOH → Na[Al(OH)4]. Ответ обосновать.
240. Уравняйте методом электронного баланса уравнения окислительно-восстановительных реакций и укажите количество молекул окислителя: Na2MoO4 + HCl + Al → MoCl2 + AlCl3 + NaCl + H2O
Дата добавления: 2015-09-29; просмотров: 2555;
