Химическое равновесие. Все химические реакции можно разбить на две группы: необратимые и обратимые
Все химические реакции можно разбить на две группы: необратимые и обратимые. Реакции, которые протекают только в одном направлении и завершают полным превращением исходных реагирующих веществ в конечные вещества называются необратимыми. Примером такой реакции может служить разложение хлората калия ( бертолетовой соли) при нагревании:

2KClO3 = 2KCl + 3O2
Реакция прекратиться тогда, когда весь KClO3 превратиться в KCl и O2. Необратимых реакций не так много. Большинство реакций являются обратимыми. Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях. В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
3H2 + N2 = 2NH3 ∆H= -46,2 кДж/моль
В технике обратимые реакции, как правило не выгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми: Признаки необратимости реакции: 1) образующиеся вещества уходят из сферы реакции – выпадают в виде осадка, выделяются в виде газа, например:
 BaCl2 + H2SO4 = BaSO4 + 2HCl
BaCl2 + H2SO4 = BaSO4 + 2HCl
 Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
2) образуется малодиссоциированное соединение, например вода:
HCl + NaOH= NaCl + H2O
3) Реакция сопровождается большим выделением энергии, например горение магния: 2Mg + O2 = 2MgO, ∆H= - 602,5 кДж/моль
В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка. Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Например, в реакции синтеза аммиака равновесие наступает тогда, когда в единицу времени образуется столько же молекул аммиака, сколько их распадается на азот и водород. Следовательно, химическое равновесие можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой. В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим равновесием. Поскольку действие обеих реакций взаимно уничтожается, то в реагирующей смеси видимых изменений не происходит: концентрации всех реагирующих веществ – как исходных, так и образующихся – остаются строго постоянными. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными. Они обычно обозначаются формулами реагирующих веществ, заключенными в квадратные скобки, например [H2], [N2], [NH3]. Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза иодоводорода:
H2 + 2 = 2HI
Согласно закону действия масс скорости прямой (Ѵ1) и обратной (Ѵ2) реакций выражают уравнениями:
Ѵ1 = K1[H2] [I2]; Ѵ2 = K2[HI]2
При равновесии скорости прямой и обратной реакций равны, откуда
K1[H2] [I2] =K2[HI]2 или K1/K2 = [HI]2/[H2] [I2]
Отношение констант скорости прямой и обратной реакции тоже представляет собой константу. Она называется константой равновесия данной реакции
(K) : K1/K2 = K
Отсюда следует:
K=[HI]2/[H2] [I2]
При постоянной температуре (K) обратимой реакция представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии. Изменение концентрации любого из этих веществ влечет за собою изменения концентраций всех остальных веществ, в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия. В случае гетерогенных реакций, например для реакции
CO2+C=2CO
K имеет вид K=[CO]2/[CO2], как видим входят концентрации только тех веществ, которые находятся только в газовой фазе ( возможно в жидкой фазе.
Величина (K) зависит от природы реагирующих веществ и от T. От присутствия катализатора не зависит. Поскольку катализатор энергию активации и прямой, и обратной реакции на одну и ту же величину, то на отношение констант их скорости он не оказывает влияния. На состояние химического равновесия оказывает влияние концентрация реагирующих веществ, T, а для газообразных веществ и давление. При изменении одного из этих параметров равновесие нарушается и концентрация всех реагирующих веществ изменяет до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния равновесия к другому называется смещением ( или сдвигом) химического равновесия. Направление смещение химического равновесия при изменениях концентрации реагирующих веществ, T и P ( в случае газовых реакций) определяется общим положением, известным под названием принципы подвижного равновесия или принципа Ле Шателье: Если на систему, находящуюся в состоянии равновесия, производится какое-либо внешнее воздействие (изменится концентрация, T, P), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
1) Влияние изменения концентрации какого-либо из веществ на смещении равновесия. Рассмотрим реакцию H2 + I2 = 2HI Пусть пары I2, H2 и HI находятся в равновесии друг с другом при определенных T и P. Введем в систему дополнительно некоторое количество H2. Увеличение концентрации количества H2 благоприятствует реакции, вызывающей уменьшение концентрации этого вещества, и , следовательно равновесие сместится в сторону образования йодоводорода или вправо. Тоже самое наблюдаем при увеличении концентрации I2. Соответственно увеличение концентрации HI смещает равновесии в сторону исходных веществ или влево. Таким образом, при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого – либо из веществ равновесие смещается в сторону образования этого вещества
2) Влияние T на смещение химического равновесия. Рассмотрим синтез аммиака
N2+3H2=2NH3 ∆H= -46,2 кДж/моль
Эта реакция экзотермическая. Поскольку прямая реакция, как видно из уравнения, протекает с выделением теплоты, повышения T смеси благоприятствует протеканию реакции с поглощением теплоты, и равновесия сместится в сторону исходных веществ, т.е. влево. Понижение T вызовет смещение равновесия в сторону продукта реакции, т.е. вправо. Синтез оксида азота (II) N2+O2=2NO ∆H=+….., представляет собой эндотермическую реакцию. Поэтому при повышении T равновесие сместится вправо в сторону образования NO. При понижении T – влево.
3) Влияние давления на смещение равновесия.
Чтобы определить влияние давления на смещение равновесия необходимо подсчитать число молекул в левой и правой частях уравнения. В уравнении для синтеза аммиака:
N2+BH2 = 2NH3 в левой части уравнения содержится четыре молекулы, а в правой две. Поскольку увеличение давления должно благоприятствовать процессу ведущему к уменьшению числа молекул , то в данном случае равновесие сместится в сторону исходных веществ. Если же в уравнении обратимой реакции число молекул в левой части равно числу молекул в правой части, например N2+O2 = 2NO , то изменение давления не вызывает смещения химического равновесия. Способы смещения равновесия в желательном направлении, основанные на принципе Ле Шателье, играют огромную роль в химии. Синтез аммиака многие другие промышленные процессы были освоены благодаря применению способов смещения равновесия в направлении, обеспечивающем высокий выход получаемого вещества.
Пример 1. Во сколько раз измениться скорость прямой и обратной реакции в системе 2SO2 (г)+ О2 (г) ↔ 2SO3 (г), если объём газовой смеси уменьшить в три раз? В какую сторону измениться равновесие системы?
Решение. Обозначим концентрации реагирующих веществ [SO2]=a, [O2]=b, [SO3]=c. Согласно закону действия масс скорости прямой и обратной реакции до изменения объёма
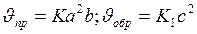
После уменьшения объёма гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2]=3a, [O2]=3b, [SO3]=3c. При новых концентрациях скорости ( 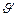 ) прямой и обратной реакции:
) прямой и обратной реакции:
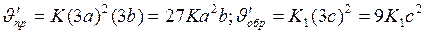
Отсюда
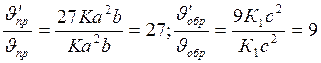
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной - только в девять раз. Равновесие системы сменилось в сторону образования SO3.
Пример 2. В системе А (г.) + 2В (г.) = С (г.) равновесные концентрации равны: 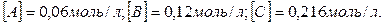 Найти константу равновесия реакции и исходные концентрации вещества А и В.
Найти константу равновесия реакции и исходные концентрации вещества А и В.
Решение. Константа равновесия данной реакции выражается уравнением:
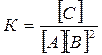 .
.
Подставляя в него данные задачи, получаем:
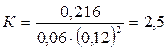

Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции, 1 моля А и 2 молей В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля вещества С, то при этом было израсходовано 0,216 моля А и 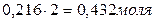 В. Таким образом, искомые исходные концентрации равны:
В. Таким образом, искомые исходные концентрации равны:
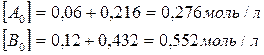
Пример 3. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле

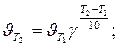

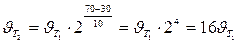
Следовательно, скорость реакции ( 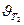 ) при температуре 70оС больше скорости реакции (
) при температуре 70оС больше скорости реакции ( 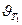 ) при температуре 30оС в 16 раз.
) при температуре 30оС в 16 раз.
Дата добавления: 2015-09-29; просмотров: 1003;
