Стандартная энергия Гиббса образования простых веществ условно принимается равной нулю.
В справочниках обычно приводятся значения стандартных энергий Гиббса образования вещества при 298 К. Зная величины 𝛥Н и 𝛥S, можно рассчитать значение 𝛥G при других температурах и, соответственно, предсказать возможность или невозможность самопроизвольного течения реакции.
Энергия Гиббcа является функцией состояния системы. Поэтому её изменение в ходе той или иной химической реакции зависит только от природы, физического или агрегатного состояния исходных веществ и продуктов реакции, их количества и не зависит от промежуточных стадий реакции или от того, каким путем данная реакционная система достигла конечного состояния, т.е.
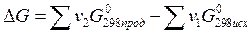 (1.29)
(1.29)
При суммировании обязательно учитывается число молей (v) всех участвующих веществ.
Пример 1. Вычислить 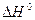 реакции, на основании стандартных теплот образования:
реакции, на основании стандартных теплот образования:
2Mg (к.) + CO2 (г.) = 2MgO (к.) + C (графит).
Решение. Используя стандартные энтальпии образования СО2 и MgO равны соответственно -393,5 и -601,8 кДж/моль (напомним, что стандартные энтальпии образования простых веществ равны нулю). Отсюда для стандартной энтальпии реакции находим:
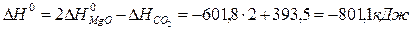
Пример 2. На основании стандартных теплот образования и абсолютных стандартных энтропий вещества вычислите 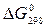 реакции, протекающей по уравнению
реакции, протекающей по уравнению
СО (г) + Н2О (ж) = СО2 (г) + Н2 (г)
Решение. 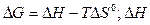 и
и 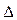 S – функции состояния, поэтому
S – функции состояния, поэтому
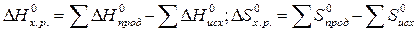
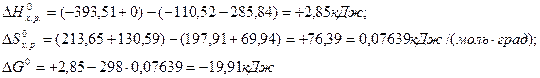
Пример 3. Восстановление Fe2O3 водородом протекает по уравнению




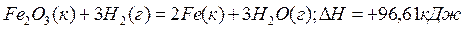
Возможна ли эта реакция при стандартных условиях, если изменение энтропии 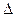 S=0,1387 кДж/(моль/град)? При какой температуре начнется восстановление Fe2O3?
S=0,1387 кДж/(моль/град)? При какой температуре начнется восстановление Fe2O3?
Решение. 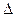 G0 реакции
G0 реакции 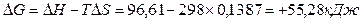 . Так как
. Так как 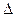 G>0, то реакция при стандартных условиях невозможна; наоборот при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой
G>0, то реакция при стандартных условиях невозможна; наоборот при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой 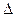 G=0:
G=0:
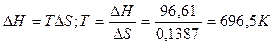
Следовательно, при температуре 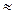 696,5К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
696,5К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
Дата добавления: 2015-09-29; просмотров: 1112;
