ТЕРМОХИМИЯ. ТЕРМОХИМИЧЕСКИЕ УРАВНЕНИЯ. ТЕРМОХИМИЧЕСКИЕ РАСЧЁТЫ
Раздел химии или химической термодинамики, занимающийся расчётами тепловых эффектов, называется термохимией.
В этом случае в состав уравнения химических реакций вводят и их тепловой эффект, а также указывают фазовые состояния веществ (к – кристаллическое, т- твердое, ж- жидкость, г – газ, р- раствор). Например:
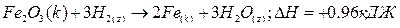
Поскольку условия получения различных веществ и их устойчивость в тех или иных условиях могут существенно различаться, вводят также и такие понятия как стандартные условия, стандартное состояние вещества и стандартная энтальпия образования вещества.
За стандартные условия принимают стандартное давление 0,1 Мпа, или 1 атм и стандартную температуру 25°С, или 298 К.
Стандартным состоянием вещества называется его состояние, наиболее устойчивое в стандартных условиях. Например, вода может находиться в трёх агрегатных состояниях: твёрдом (лёд), жидком и газообразном (пар). Из них при стандартных условиях наиболее устойчивым является жидкое, которое и считается стандартным. Для металлов, за исключением ртути, стандартным состоянием является твёрдое (кристаллическое), а для ртути - жидкое. Такие вещества, как водород Н2, углекислый газ С02, азот N2 и другие, в стандартном состоянии газообразны.
Энтальпии (теплоты) образования веществ в стандартном состоянии и стандартных условиях называются стандартными, и обозначаются символом 𝛥Н°298 обр или 𝛥Н°298 г. В последнее время - просто как 𝛥Н°298- Верхний индекс отмечает стандартное состояние вещества, нижний - стандартную температуру. Теплота образования вещества связана с его количеством и выражается в Дж/моль или кДж/моль.
Следует отметить, и это с очевидностью следует из принятого определения энтальпии образования вещества, что стандартные энтальпии образования простых веществ 𝛥Н°0бР298 (например, 02 (Г), Н2 (Г), С (графит) и др.) условно приняты равными нулю.
Если химический элемент образует несколько простых веществ, то стандартным считается наиболее устойчивое из них при стандартных условиях. Например, элемент кислород образует два простых вещества: О2 и Оз (озон). Известно, что наиболее устойчивым из них при стандартных условиях является О2, поэтому стандартная теплота его образования считается равной нулю. Теплота же образования озона составляет -142 кДж/моль, поскольку при его образовании из молекулярного кислорода О2 поглощается 142 кДж.
Теплоты (энтальпии) образования соединений, которые могут быть получены непосредственно из соответствующих простых веществ, определяют экспериментально. Их стандартные значения сведены в специальные термодинамические справочники. По справочным данным можно, не прибегая к эксперименту, рассчитывать тепловые эффекты различных реакций и проводить другие вычисления. Например, когда какое-то вещество невозможно экспериментально получить из простых веществ, то энтальпию его образования вычисляют, исходя из косвенных данных.
В основе термохимических расчётов реакций лежит закон Гесса:
Дата добавления: 2015-09-29; просмотров: 1292;
