ВНУТРЕННЯЯ ЭНЕРГИЯ и ЭНТАЛЬПИЯ
Термодинамические величины. Внутренняя энергия и энтальпия. Внутренняя энергия V вещества (или системы) — это полная энергия частиц, составляющих данное вещество. Она слагается из кинетической и потенциальной энергий частиц. Кинетическая энергия — это энергия поступательного, колебательного и вращательного движения частиц; потенциальная энергия обусловлена силами притяжения и отталкивания, действующими между частицами.
Внутренняя энергия зависит от состояния вещества. Изменение внутренней энергии системы 𝛥U при том или ином процессе можно определять. Пусть в результате какого-нибудь процесса система переходит из начального состояния 1 в конечное состояние 2, совершая при этом работу А и поглощая из внешней среды теплоту Q. Ясно, что внутренняя энергия системы уменьшится на величину А, возрастет на величину Q и в конечном состоянии будет равна:
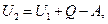
где U1 и U2 — внутренняя энергия системы в начальном (1) и в конечном (2) состояниях. Если обозначить разность 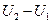 через 𝛥U, то уравнение можно представить в виде:
через 𝛥U, то уравнение можно представить в виде:
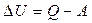
Это уравнение выражает закон сохранения энергии, согласно которому изменение внутренней энергии не зависит от способа проведения процесса, а определяется только начальным и конечным состояниями системы. Однако какая часть энергии пойдет на совершение работы, а какая превратится в теплоту — зависит от способа проведения процесса: соотношение между работой и теплотой может быть различным. В частности, если в ходе процесса не производится никакой работы, в том числе работы расширения против внешнего давления, т.е., если объем системы не изменяется, то
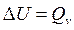 где
где 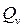 - теплота, поглощенная системой в условиях постоянного объема.
- теплота, поглощенная системой в условиях постоянного объема.
Последнее уравнение дает возможность определять изменение, внутренней энергии при различных процессах.
Энтальпия. Однако чаще в химии приходится иметь дело с процессами, протекающими при постоянном давлении. При этом удобно пользоваться величиной энтальпии Н, определяемой соотношением:
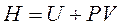
При постоянном давлении и при условии, что в ходе процесса совершается только работа расширения 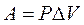
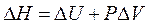
или
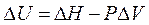
Сравнивая последнее уравнение с уравнением внутренней энергии
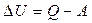
видим, что при указанных условиях
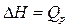
где 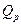 — теплота, поглощенная системой при постоянном давлении.
— теплота, поглощенная системой при постоянном давлении.
Последнее уравнение дает возможность определять изменение энтальпии при различных процессах. Такие определения аналогичны определениям внутренней энергии, с той разницей, что все измерения должны проводиться в условиях постоянного давления.
Если в системе имеет место химическая реакция, то её протекание, как известно, будет сопровождаться выделением или поглощением энергии в виде теплоты. В тех случаях, когда теплота выделяется (𝛥Н < 0 или 𝛥U< 0), реакции называются экзотермическими, а когда поглощается (𝛥Н > 0 или 𝛥U > 0) - эндотермическими. Теплоты химических процессов, протекающих в изохорно-изотермических изотермических условиях, называют тепловыми эффектами. Тепловые эффекты реакций измеряются в Дж/моль или к Дж/моль. Тепловые эффекты реакций определяются как экспериментально, так и с помощью термохимических расчетов.
Дата добавления: 2015-09-29; просмотров: 1236;
