Измерение электродных потенциалов. Ряд стандартных электродных потенциалов
Измерить абсолютную величину электродного потенциала невозможно. С помощью того или иного прибора можно измерить разность потенциалов между двумя электродами (ЭДС). Для того, чтобы получить численные значения потенциалов различных электродов и иметь возможность сравнивать их, нужно было какой-нибудь электрод выбрать в качестве эталона и по отношению к нему измерять все потенциалы. Таким эталоном является стандартный водородный электрод.
Стандартный потенциал водородного электрода – это потенциал при температуре 298К, давлении водорода 1 атм и активности ионов водорода в растворе 1  . Условно стандартный потенциал водородного электрода
. Условно стандартный потенциал водородного электрода 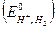 принят равным нулю. По отношению к нему выражают потенциалы всех других электродов (Е0).
принят равным нулю. По отношению к нему выражают потенциалы всех других электродов (Е0).
Если измерить стандартные электродные потенциалы различных металлов по отношению к потенциалу стандартного водородного электрода и расположить их в порядке увеличения, получим ряд напряжений металлов:
| Металл | К | Mg | Al | Zn | Fe | Ni | Sn | Pb | H | Cu | Ag | Pt |
| Е0, В | -2,92 | -2,38 | -1,66 | -0,76 | -0,44 | -0,23 | -0,14 | -0,13 | 0,00 | +0,34 | 0,80 | 1,20 |
В этом ряду слева направо происходит уменьшение химической активности металлов. Положение металлов в ряду напряжений позволяет предсказать возможность самопроизвольного протекания реакции замещения.
Дата добавления: 2015-09-28; просмотров: 1608;
