Экспериментальная часть. Количественная характеристика гальванического элемента – электродвижущая сила (ЭДС), равна разности его электродных потенциалов при бесконечно медленном и
Количественная характеристика гальванического элемента – электродвижущая сила (ЭДС), равна разности его электродных потенциалов при бесконечно медленном и обратимом протекании химической реакции в гальваническом элементе.ЭДС должна быть положительной, так как работу, совершаемую системой, принято считать положительной.
Для измерения ЭДС обратимого гальванического элемента необходимо, чтобы процесс совершался бесконечно медленно, т.е. чтобы элемент работал при бесконечно малой силе тока. Это условие выполняется в компенсационном методе измерения, который основан на том, что исследуемый элемент включается против внешней разности потенциалов, и последняя подбирается так, чтобы ток в цепи отсутствовал. В этом случае ЭДС изучаемого элемента равна внешней разности потенциалов.
Схема установки для измерения ЭДС компенсационным методом дана на рис 4.3.
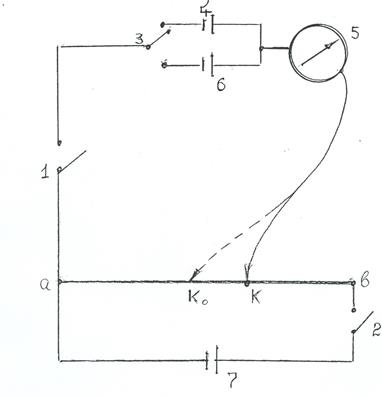
Рис. 4.3. Компенсационная схема для измерения ЭДС
1 – ключ для замыкания гальванометра;
2 – выключатель аккумулятора; 3 – переключатель тока;
4 – нормальный элемент; 5 – гальванометр; 6 – исследуемый
элемент; 7 – аккумулятор; К – подвижный контакт; ав – реохорд.
Источник постоянного тока, аккумулятор 7, подключают к концам реохорда ав. Реохорд ав -проволока, натянутая на линейку со шкалой. Проволока должна быть однородной по толщине со значительным сопротивлением. При этом условии падение напряжения на всем протяжении ее от а до в пропорционально длине проволоки. Элемент, ЭДС которого измеряется 6, подключают к реохорду в точке а и через гальванометр 5 к подвижному контакту К. Аккумулятор и исследуемый элемент включают таким образом, чтобы их токи протекали навстречу друг к другу, т.е. их электродвижущие силы Еак и Ех компенсируются. Перемещая подвижный контакт К реохорда ав, находят такое его положение, при котором гальванометр покажет отсутствие тока. Это означает, что падение потенциала на участке аК точно равно ЭДС исследуемого элемента. Тогда можно записать следующее отношение:
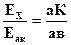 (4.5)
(4.5)
Электродвижущая сила аккумулятора – величина, точное значение которой неизвестно. Поэтому для компенсационных измерений обязательно требуется эталон – гальванический элемент, электродвижущая сила которого постоянна и известна.В качестве такого элемента применяют нормальный элемент Вестона 4, ЭДС которого при температуре Т можно вычислить по формуле:
Е0 = 1,0183 - 4× 10−5 (Т-293)
Его включают в компенсационную установку вместо исследуемого элемента и определяют сопротивление, соответствующее отрезку аК0 на реохорде, когда электродвижущая сила нормального элемента Е0 будет компенсирована. Тогда
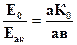 (4.6)
(4.6)
Разделив уравнение (4.6) на уравнение (4.5), получим:
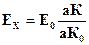 (4.7)
(4.7)
Порядок выполнения работы следующий.
Собирают цепь из медного и цинкового электродов. Находят точку компенсации для нормального элемента, для чего включают в цепь аккумулятор и нормальный элемент. Передвигая подвижный контакт по реохорду и время от времени замыкая цепь телеграфным ключом, наблюдают за движением стрелки гальванометра. Момент компенсации наступает тогда, когда стрелка гальванометра при замакании ключа показывает отсутствие тока. Положение найденного места компенсации в см, обозначенное через аК0, заносят в соответствующую графу формы записи результатов наблюдений. Затем с помощью переключателя отключают нормальный элемент и включают в цепь исследуемый медно-цинковый элемент, для которого таким же образом, как и для нормального элемента находят положение подвижного контакта реохорда в момент компенсации, и величину аК также заносят в соответствующую графу формы записи. Определение точек компенсации проводят 3 раза.
ЭДС гальванического элемента рассчитывают по формуле:
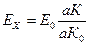
где Е0 – ЭДС нормального элемента; аК – длина отрезка проволоки в см при компенсации с исследуемым элементом; аК0 – длина отрезка проволоки в см при компенсации с нормальным элементом.
Пользуясь таблицей стандартных потенциалов, вычисляют теоретическое значение ЭДС для этой же цепи по уравнению
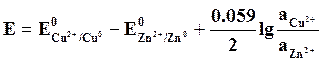 (4.8)
(4.8)
Условно принимают, что активности ионов металлов в растворе равны друг другу.
Результаты измерений заносят в таблицу.
Таблица
| аК0, см | аК, см | Ех (опытное), В | Ех (рассчит.), В |
| 1. | 1. | ||
| 2. | 2. | ||
| 3. | 3. | ||
| аК0 (ср) = | аК(ср) = |
Дата добавления: 2015-09-28; просмотров: 1695;
