Факторы, влияющие на величину электродного потенциала
Электродный равновесный потенциал зависит от следующих основных факторов.
От природы металла. Чем большей химической активностью обладает данный металл, тем в большей степени равновесие (4.1) смещено вправо, тем отрицательнее потенциал.
От концентрации ионов металла в растворе.Переход ионов металла в раствор происходит тем интенсивнее, чем меньше концентрация катионов в растворе. Наоборот, с увеличением концентрации раствора равновесие (4.1) смещается влево и потенциал становится более положительным.
От температуры. С повышением температуры потенциал становится более положительным, т.е. равновесие (4.1) смещается влево.
Зависимость величины потенциала от указанных факторов выражается уравнением Нернста:
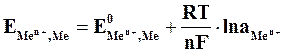 , (4.2)
, (4.2)
где 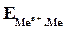 - электродный потенциал металла (Ме) в растворе, содержащем катионы
- электродный потенциал металла (Ме) в растворе, содержащем катионы  ;
;  - стандартный или нормальный потенциал рассматриваемой системы; R – универсальная газовая постоянная; Т - температура по шкале Кельвина; n – число электронов, участвующих в электродном процессе; F - число Фарадея; а
- стандартный или нормальный потенциал рассматриваемой системы; R – универсальная газовая постоянная; Т - температура по шкале Кельвина; n – число электронов, участвующих в электродном процессе; F - число Фарадея; а 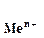 - активность ионов металла в растворе. Для разбавленных растворов коэффициент активности близок к единице и вместо активности можно пользоваться концентрацией ионов в растворе.
- активность ионов металла в растворе. Для разбавленных растворов коэффициент активности близок к единице и вместо активности можно пользоваться концентрацией ионов в растворе.
Если в уравнение (4.2) подставить значения постоянных R, F, принять температуру для стандартных условий (Т0 = 298К) и перейти от натуральных к десятичным логарифмам, получим:
 (4.3)
(4.3)
Из уравнения (4.3) следует, что стандартный электродный потенциал (E0) – это потенциал электрода при стандартных условиях: 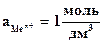 , Т=298 К.
, Т=298 К.
Величина (Е0) характеризует химическую активность металла.
4.4. Типы электродов
В зависимости от свойств веществ, участвующих в электродных процессах, все электроды можно разделить на несколько типов.
Электроды первого рода. К этому типу относятся все металлические электроды в водородный электрод. Условное обозначение таких электродов: Ме|Меn+, например Cu|Cu2+, водородный: (Pt)H2|H+. Вертикальная черта символизирует поверхность раздела фаз. Общим для этих электродов является то, что в равновесии на электроде участвуют нейтральные атомы (или молекулы) и один вид катионов. Такие электроды являются обратимыми относительно катионов.
Электроды второго рода.Такие электроды состоят из трех фаз: металл покрыт слоем труднорастворимой соли этого металла, а в растворе, куда он опущен, находятся те же анионы, которые входят в состав труднорастворимой соли.
Например, хлорсеребряный электрод: Ag, AgCl|KCl; каломельный электрод: Hg, Hg2Cl2|KCl.
Между твердой фазой и раствором на этих электродах возникают следующие равновесия:
Ag + Cl− − ē D AgCl
2Hg + 2Cl− − 2ē D Hg2Cl2
В отличие от электродов первого рода здесь в равновесии участвуют анионы, т.е. электроды второго рода обратимы относительно анионов. Величина потенциала этих электродов зависит от концентрации анионов:

Эти электроды в лабораторной практике обычно используют в качестве электродов сравнения.
Окислительно-восстановительные электроды. Эти электроды представляют собой пластинку из благородного металла (чаще всего платины), погруженную в раствор, содержащий ионы одного элемента в разной степени окисления. Например, Pt|Fe3+, Fe2+; Pt|Sn4+, Sn2+.
На поверхности платины происходит обмен электронами между ионами и устанавливаются равновесия:
Fe2+ − ē D Fe3+
Sn2+ − 2ē D Sn4+
Платина в этих равновесиях не участвует и играет роль переносчика электронов. Величина потенциала может быть рассчитана по уравнению Нернста:
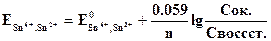 , (4.4)
, (4.4)
где 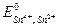 - стандартный окислительно-восстановительный потенциал; n – число электронов, участвующих в электродной реакции (для данной системы n=2); Сок., Свосст. – концентрация ионов в высшей и низшей степени окисления соответственно.
- стандартный окислительно-восстановительный потенциал; n – число электронов, участвующих в электродной реакции (для данной системы n=2); Сок., Свосст. – концентрация ионов в высшей и низшей степени окисления соответственно.
Величина стандартного окислительно-восстановительного потенциала характеризует свойства окислителей и восстановителей, а именно:
чем выше Е0, тем более сильным окислителем являются ионы в высшей степени окисления;
Дата добавления: 2015-09-28; просмотров: 15194;
