Электрохимические процессы. Гальванический элемент
Электрохимическим (гальваническим) элементом называется устройство (прибор) для получения электрического тока за счет химических реакций, протекающих на электродах. Простейший электрохимический элемент состоит из двух полуэлементов – металлических пластин (электродов), которые опущены в растворы электролитов (например, соли этих металлов). Растворы электролитов соединяются между собой (чаще с помощью солевого мостика, чтобы свести к минимуму диффузный потенциал, возникающий на границе растворов). При этом на электродах возникают разные по величине равновесные электродные потенциалы, разность которых и определяет электродвижущую силу (ЭДС) данного гальванического элемента.
4.1. Механизм возникновения электродного потенциала
Металлы имеют кристаллическое строение. Для образования элементарной ячейки кристалла каждый атом металла предоставляет валентные электроны для образования химической связи в кристалле, а сам в виде катиона «садится» в узел кристаллической решетки. В такой элементарной ячейке кристалла большое количество (более двух) электронов одновременно «обслуживает» все ядра узлов решетки. Такая химическая связь называется металлической. При этом элементарная ячейка кристаллической решетки электронейтральна.
Если погрузить металлическую пластинку в водный раствор соли того же металла, то на границе металл-раствор будут идти два процесса, схематично показанные на рис. 4.1. Металлическая пластинка на рисунке показана в виде части кристаллической решетки, в узлах которой катионы металла, между ними валентные электроны. В растворе соли этого металла находятся три типа частиц: катионы металла (Å), анионы кислотного остатка
 |
(Θ) и молекулы воды . Эти частицы постоянно «бьются» о поверхность металла, так как их количество огромно (порядка 1023 штук).
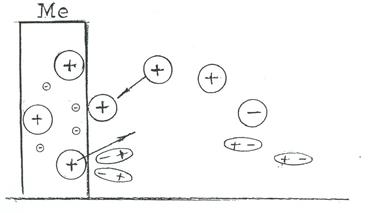
Рис. 4.1.Схема процессов, происходящих на границе металл-раствор
Положительные ионы металла из узлов кристаллической решетки, находящихся на поверхности, гидратируются (в результате взаимодействия с молекулами воды) и некоторое их количество переходит в раствор. В результате этого перехода на пластинке образуется избыток электронов, она заряжается отрицательно. Энергия этого процесса – энергия гидратации (Ег).
В то же время гидратированные катионы металла, находящиеся в растворе, отбирая на поверхности металла электроны, образуют атомы металла, которые становятся частью кристаллической решетки. Этот процесс приводит к дефициту электронов и пластинка заражается положительно. Энергия этого процесса – энергия выхода иона металла из раствора (Ев). В зависимости от того, какой из двух процессов преобладает, т.е. какая из энергий (Ег или Ев) больше, пластинка заряжается отрицательно или положительно. Преобладание того или иного процесса идет до состояния равновесия, при котором скорости этих процессов выравниваются.
Таким образом, между металлическим электродом и раствором устанавливается состояние равновесия, которое можно представить в виде следующей схемы:
Ме - nē D Меn+ (4.1)
Если металл зарядился отрицательно и наступило равновесие (рис. 4.2.), то катионы металла из раствора притягиваясь концентрируются вблизи поверхности. Образуются двойной электрический слой, состоящий из адсорбционного и диффузного слоя, что определяется тепловым движением. Если металл заряжается положительно, то картина обратная. Возникает определенный скачек потенциала, который принято называть электродным потенциалом.
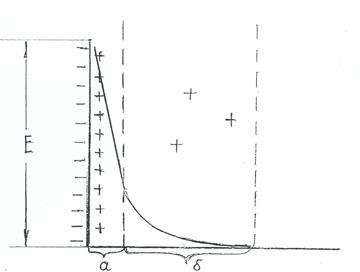
Рис. 4.2.Схема строения двойного электрического слоя.
а – адсорбционный, б – диффузионный слои
Дата добавления: 2015-09-28; просмотров: 1265;
