Молярная электрическая проводимость
Молярной электрической проводимостью (l) называется электрическая проводимость объема раствора, содержащего 1 кмоль растворенного вещества и помещенного между электродами, находящимися на расстоянии 1м друг от друга.И тогда
l = æ × V.
Концентрация вещества (с) связана с объемом раствора (V), содержащим 1 кмоль электролита, соотношением:
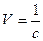 .
.
Величина 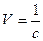 называется разведением или разбавлениемраствора и показывает объем раствора (м3) данной концентрации, в котором содержится 1 кмоль растворенного вещества. Например, для 0,1М раствора разведение равно V=1/0.1=10м3, т.е. именно в 10м3 0,1М раствора содержится 1 кмоль растворенного вещества.
называется разведением или разбавлениемраствора и показывает объем раствора (м3) данной концентрации, в котором содержится 1 кмоль растворенного вещества. Например, для 0,1М раствора разведение равно V=1/0.1=10м3, т.е. именно в 10м3 0,1М раствора содержится 1 кмоль растворенного вещества.
С учетом концентрации уравнение для молярной электропроводности запишется в виде:
l 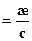
 (3.2)
(3.2)
Молярная электропроводность как сильных так и слабых электролитов увеличивается с уменьшением концентрации, т.е. с увеличением разведения раствора, и достигает некоторого предельного значения, называемого молярной электрической проводимостью при бесконечном разбавлении (l∞) (рис. 3.1).
Для сильных электролитов при увеличении разведения вследствие уменьшения взаимодействия между ионами увеличивается скорость их движения, и молярная электропроводность увеличивается, достигая своего предельного значения при бесконечном разведении.
Для слабого электролита различие в молярных электропроводностях при разных разведениях обусловлено, в основном, только различием в числе ионов, образующихся при соответствующем разведении, т.е. степенью
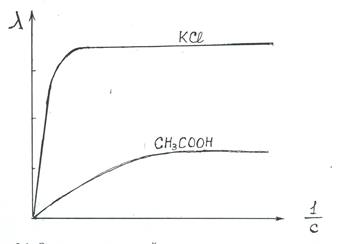
Рис. 3.1.Зависимость молярной электропроводности некоторых электролитов от разведения
диссоциации электролита (a). В соответствии с принципом Ле Шателье-Брауна (принципом смещения равновесия при внешнем воздействии) равновесие в растворе слабого электролита при разбавлении смешается в сторону реакции диссоциации, т.е. увеличения (a). Поэтому и возрастает число ионов в растворе, а следовательно и (l). Можно принять, что отношение (l) при каком-то конкретном равновесии к (l∞) равно отношению соответствующих степеней диссоциации:
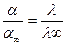
Поскольку a∞→ 1, то
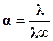 . (3.3)
. (3.3)
Молярная электропроводность при бесконечном разведении (l∞) равна сумме электролитических подвижностей катиона и аниона данного электролита. Это закон независимости движения ионов Кольрауша:
l∞ = l+ +l −,
где l+ и l − - электролитическая подвижность катиона и аниона соответственно, которая есть не что иное, как произведение абсолютной скорости движения ионов (U+ и U−) на постоянную Фарадея (F). И тогда
l∞ =FU+ +FU−(3.4)
Таким образом, измерив молярную электропроводность (l) раствора электролита и рассчитав (l∞) по уравнению (3.4), можно определить по формуле (3.3) степень диссоциации (a) слабого электролита. Для слабого электролита его способность к диссоциации характеризуется константой диссоциации (Кд), которая связана со степенью диссоциации:
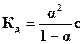 (3.5)
(3.5)
Подставив значение (a) из (3.3), получим:
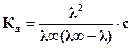 (3.6)
(3.6)
Уравнение (3.6) позволяет непосредственно оценить константу электролитической диссоциации, если известна молярная электрическая проводимость раствора.
Дата добавления: 2015-09-28; просмотров: 2852;
