Сильные и слабые электролиты
Электролитами называются соединения, молекулы которых в растворе диссоциируют на ионы (положительно и отрицательно заряженные частицы)
Причиной электролитической диссоциации является взаимодействие молекул растворенного вещества с молекулами растворителя (сольватация, гидратация). Именно гидратация ионов препятствует обратному соединению ионов в молекулы.
По способности образовывать ионы в растворе электролиты делят на две группы: слабые и сильные.
В растворах сильных электролитов все молекулы распадаются (диссоциируют) на ионы.К ним относятся сильные кислоты и основания, большинство солей.
В растворах слабых электролитов только часть молекул диссоциирует на ионы. Процесс диссоциации в этом случае идет до состояния равновесия.Параметр, показывающий, какая часть молекул слабого электролита продиссоциировала на ионы, называется степенью диссоциации (a). Величина (a) выражается в виде десятичной дроби или в процентах. К слабым электролитам относятся слабые кислоты и основания, а также некоторые соли, большинство органических кислот, фенолы, амины. Равновесие диссоциации слабого электролита характеризуется константой электролитической диссоциации, которая представляет собой отношение произведения молярных концентраций ионов к молярной концентрации нераспавшихся молекул. Например, для диссоциации слабого электролита АВ
АВD А+ + В-
Кд= 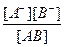 .
.
Хотя сильные электролиты полностью диссоциируют в растворе на ионы, изучение различных их свойств (давление насыщенного пара, повышение температуры кипения и т.п.) показывает, что не все ионы являются в растворе свободными. Особенно это проявляется в концентрированных растворах, что обусловлено электростатическим взаимодействием между ионами. Силы межионного взаимодействия зависят от расстояния между ионами, зависящего от концентрации раствора, природы электролита и среды. Наличие этих сил проводит к тому, что каждый ион оказывается окруженным «ионной атмосферой», преимущественно из ионов противоположного по знаку заряда. При разбавлении раствора расстояние между ионами увеличивается и межионное взаимодействие ослабевает, подвижность ионов возрастает. Она становится максимальной при бесконечном разбавлении раствора. Активную концентрацию электролита (т.е. количество свободных ионов) принято характеризовать активностью (а).Для бесконечно разбавленных растворов, где отсутствует межионное взаимодействие, активность раствора равна его концентрации. Активность ионов связана с концентрацией (с) выражением:
а= g с.
Величина (g) называется коэффициентом активности и характеризует межионное взаимодействие.
Дата добавления: 2015-09-28; просмотров: 1022;
