Наиболее значимые мономерные двухэлементные материалы
Вода. Вода - самое распространенное химическое вещество. Она представляет собой оксид водорода Н2О. Молекула воды имеет угловое строение (рис. 3.1). Связи О-Н в молекуле полярны (общая электронная пара смещена к атомному остову кислорода, который обладает большей электроотрицательностью). При взаимодействии противоположно заряженных частей отдельных молекул образуются достаточно прочные водородные связи (рис. 3.2).
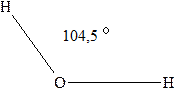
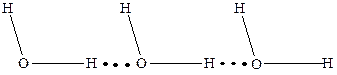
Рис. 3.1 - Угловая молекула воды Рис. 3.2 - Водородные связи в молекуле воды
Вследствие образования водородных связей молекулы воды объединяются в ассоциаты (Н2О)n. Ассоциация воды определяет ряд ее особых свойств (аномалия плотности, высокая температура кипения). Водородные связи разрушаются с повышением температуры, ассоциация молекул при этом уменьшается. В парах воды существуют отдельные молекулы Н2О.
Вода в твердом состоянии представляет собой кристаллическое вещество, называемое льдом (рис. 3.3). В кристалле льда ядерный остов кислорода каждой молекулы воды образует две водородные связи с соседними молекулами (рис. 3.4).
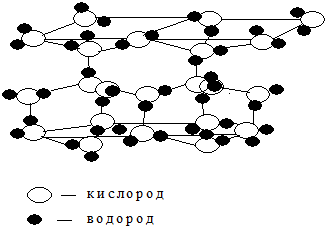
Рис. 3.3- Кристаллическая структура льда
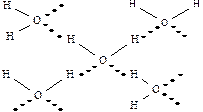
Рис. 3.4 - Водородные связи в кристалликах льда
При обычных условиях вода представляет собой прозрачную жидкость без цвета и запаха. Плотность ее зависит от температуры, максимальную плотность она имеет при температуре 4 °С (1,00 г/см3). Вода замерзает при 0 °С, кипит при 100°С (нормальное давление). Достаточно высокие температуры плавления и кипения оксида водорода обусловлены ассоциацией молекул. Вода является хорошим растворителем большого числа веществ, например щелочей, многих кислот и солей.
Химическая активность воды достаточно высокая, она реагирует со многими простыми и сложными веществами. Вода взаимодействует с большим количеством металлов с выделением водорода. Реакция с активными металлами (щелочными, щелочноземельными) протекает при обычных условиях, с менее активными - при высокой температуре (в парообразном состоянии). При нормальных условиях оксид водорода взаимодействует со многими кислотными и основными оксидами, образуя соответственно кислоты и основания. При растворении солей, кислот и оснований в воде происходит образование гидратов и кристаллогидратов.
Оксид изотопа водорода дейтерия D2O называется тяжелой водой. Она в незначительных: количествах содержится вприродной воде и может быть выделена из нее. Температура замерзания тяжелой воды составляет 3,81 °С, температура кипения 101,43 °С. Она имеет большую плотность по сравнению с обычной водой. Химические свойства тяжелой воды аналогичны свойствам обычной воды, однако реакции с участием D2O протекают с меньшей скоростью, чем с Н2О.
В природной воде всегда имеются механические примеси и растворенные вещества. Примеси твердых веществ отделяются от воды фильтрованием, которое заключается в пропускании ее через материал, задерживающий твердые частицы. Фильтрующими материалами могут служить бумага, песок, вата, ткани и другие зернистые или пористые материалы.
Методом очистки воды от растворенных веществ является перегонка (рис. 3.5) или дистилляция.
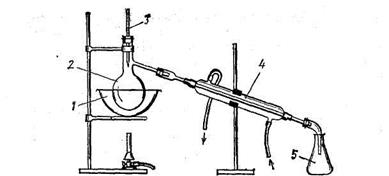
Рис. 3.5- Простейшая установка для перегонки воды: 1 - водяная баня; 2- колба; 3 - термометр; 4 -холодильник; 5 - приемник
При нагревании воды в перегонном аппарате вначале отгоняются примеси с температурами кипения более низкими, чем у воды, затем перегоняется сама вода, а примеси с более высокими температурами кипения образуют остаток. Проводя перегонку несколько раз, и используя на отдельных ее стадиях химические добавки (например, окислители для окисления примесей), можно получить очень чистую воду. Вода, полученная в результате перегонки, называется дистиллированной.
Для очистки воды широко используют ионообменные смолы. Этот метод значительно проще перегонки, его широко применяют в промышленности. С помощью ионообменных смол вода особенно хорошо очищается от примесей неорганических веществ (но содержание органических примесей иногда даже увеличивается).
Вода, в которой растворено большое количество солей кальция и магния, называется жесткой. Жесткость воды бывает временной (устранимой) и постоянной. Временная жесткость обусловлена присутствием в воде гиброкарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. Ее еще называют карбонатной жесткостью. Устранимой она является потому, что гиброкарбонаты при кипячении воды разлагаются в образованием нерастворимых карбонатов CaCO3 и MgCO3, выпадающих в осадок, и углекислого газа. Вода с постоянной жесткостью содержит в своем составе в основном хлориды и сульфаты кальция и магния. При кипячении такой воды данные соединения не разлагаются и жесткость не снижается. Общая жесткость воды определяется суммой карбонатной и постоянной жесткости. Степень жесткости определяется по разному. В России она определяется числом миллиграмм-эквивиалентов ионов кальция и магния в одном литре воды, мг-экв/л. По величине жесткости вода подразделяется на: очень мягкую – общая жесткость составляет до 1,5 мг-экв/л, среднюю – от 4,0 мг-экв/л до 8,0 мг-экв/л, жесткую – от 8,0 мг-экв/л до 12,0 мг-экв/л, очень жесткую – свыше 12,0 мг-экв/л. Особенно большой жесткостью обладает морская вода. Вода Черного моря имеет кальциевую жесткость равной 12,0 мг-экв/л, магниевую - 53,5 мг-экв/л и общую - 65,5 мг-экв/л, Каспийское море заполнено водой с кальциевой жесткостью равной 36,4 мг-экв/л, магниевой - 30,0 мг-экв/л и общей - 66,4 мг-экв/л. Вода океанов еще более жесткая и имеет кальциевую жесткость равной 22,5 мг-экв/л, магниевую - 108,0 мг-экв/л и общую - 130,5 мг-экв/л.
Чистая вода необходима многим отраслям современной промышленности, она используется для проведения большого числа технологических процессов. Очищенная питьевая вода применяется в бытовых целях.
Оксид углерода(П).Одним из производныхуглерода(II) является его оксид СО. Он представляет собой бесцветный газ без запаха, очень ядовит, вызывает удушье. Этим обусловлено его распространенное название угарный газ.
В природе и быту он выделяется при сгорании различного топлива (дров, угля, природного газа, бензина) в условиях недостатка кислорода. В промышленности СО получают, пропуская оксид углерода (IV) СО2 над углем при нагревании.
При горении оксида углерода(II) в кислороде и на воздухе происходит выделение большого количества теплоты. В обычных условиях он вполне устойчив и химически весьма инертен.
При нагревании оксид углерода(II) проявляет восстановительные свойства при взаимодействии с неметаллами, в частности, окисляется серой. При 700 °С он сгорает синим пламенем в кислороде, выделяя большое количество тепла. В присутствии катализатора или при облучении СО взаимодействует с хлором, образуя оксохлорид СОС12 и т. д. Оксид углерода(II) восстанавливает металлы из их соединений, например, оксидов. Он взаимодействует с некоторыми металлами, с образованием карбонилов, например, тетракарбонила никеля Ni(CO)4. Монооксид углерода является несолеобразующим (индифферентным) оксидом, он не взаимодействует ни с кислотами, ни с щелочами при обычных условиях.
Оксид углерода(II) CO (угарный газ) применяется в качестве топлива, его вводят в состав некоторых горючих смесей: генераторного, водяного, топочного светильного газов. Он также используется в металлургической промышленности как сильный восстановитель металлов из их руд, поэтому его применяют при производстве железа. Его соединения с металлами карбонилы используются также в металлургической промышленности для получения металлов высокой чистоты.
Оксид углерода(IV). В степени окисления (IV) углерод образует соединение с кислородом называемое диоксидом углерода СО2. В промышленности оксид углерода(IV) получают при сжигании угля или при прокаливании известняка СаСО3. В лаборатории СО2 получают действием сильных кислот на карбонаты металлов.
Оксид углерода(IV)это газообразное бесцветное вещество с температурами сублимации и кипения равными соответственно -78,5 °С и -56,5°С. Он известен также под названием углекислый газ. При пониженной температуре или повышенном давлении СО2 легко переходит в жидкое и твердое состояние.
Твердый оксид углерода(IV) называется сухим льдом. В больших концентрациях он вреден для человека и животных, может вызвать удушье, не поддерживает горения: зажженная лучинка, внесенная в углекислый газ, гаснет. Это явление обычно используют для обнаружения СО2. Диоксид углерода растворяется в воде незначительно (при 0 °С в 1 л воды - 1,7 л СО2, а при 15 °С - 1 л СО2). При растворении небольшая часть растворенного СО2 реагирует с водой с образованием угольной кислоты Н2СО3.
Диоксид углерода как кислотный оксид реагирует с основными оксидами и основаниями с образованием солей угольной кислоты - карбонатов. Он поглощается растворами щелочей с формированием соответствующего карбоната, а при избытке оксида углерода(IV) – гидрокарбоната.
Оксид углерода(IV) CO2 (углекислый газ) применяется в производстве сахара, соды, для приготовления газированных напитков, наполнения огнетушителей, как охлаждающий агент, как инертную среду при проведении различных синтезов. Он также входит в состав некоторых горючих смесей: топочного и рудничных газов.
Оксид азота(II). При непосредственном взаимодействии азота с кислородом при высокой температуре образуется оксид азота(II) NО. В лабораторных условиях его синтезируют обычно при действии разбавленной азотной кислоты на металлическую медь Промышленный метод производства заключается в окислении аммиака на платиновом катализаторе. Оксид азота(II) представляет собой бесцветный газ плавящийся при -163,7 °С; кипящий при -151,7 °С На воздухе он окисляется с образованием диоксида NO2. Молекула NО парамагнитна. Вследствие повышенной кратности связи оксид азота(II) достаточно устойчив, и его распад становится заметным лишь при 500 °С. Он является химически активным соединением, легко восстанавливается (при действии SО2, Cr2+) в растворах до NH2OH и H3N; с водородом образует гремучую смесь. Легко окисляется кислородом, галогенами и др. неметаллами. Только при понижении температуры NО димеризуется, и твердый оксид азота (II) (синего цвета) состоит из неустойчивых диамагнитных молекул N2O2. Производные NO неустойчивы и изучены недостаточно. Он входит в состав некоторых горючих смесей: а именно, топочного газа.
Сероводород и сероводородная кислота. При взаимодействии серы с водородом при высокой температуре образуется сероводород H2S. Таким способом он и получается в промышленности. Действием сильных кислот, например, соляной на сульфид железа(II) синтезируют сероводород в лабораторных условиях.
Он представляет собой бесцветный газ с запахом тухлых яиц. Сильно ядовит. Растворим в воде. Сероводород относится к сильным восстановителям. При взаимодействии с такими окислителями, как перманганат калия КМnО4, и азотная кислота он окисляется до серы и оксида серы(IV) SO2 соответственно. Сероводород также окисляется кислородом. При его недостатке происходит образование серы, а избыток кислорода вызывает более глубокое окисление до оксида серы(IV) SO2. Сероводород растворяется в воде. Его растворимость в воде при 20 °С составляет 0,36 %. Данный раствор называют сероводородной кислотой. Она является слабой кислотой. Ее соли называют сульфидами (средние) и гидросульфидами (кислые). Их обычно получают, пропуская газообразный сероводород через водные растворы щелочей или солей. Кислые соли формируются чаще всего при избытке сероводорода. Реакции обмена в водных растворах солей с сероводородом реализуются лишь при образовании малорастворимого сульфида металла, например, сульфид свинца(II) или другие.
Оксид серы(IV) и его гидрат. При взаимодействии серы с кислородом при повышенной температуре образуется оксид серы(IV) SO2. В лабораторных условиях его синтезируют следующими способами: действием концентрированной серной кислоты на медь при нагревании; сжиганием серы на воздухе или действием кислот на гидросульфиты, например гидросульфит калия KHSO3.
В промышленности SO2 получают главным образом при обжиге сульфидов металлов.
Это газ без цвета и запаха. Его еще называют сернистым газом. Он является кислотным оксидом. Оксид серы(IV) хорошо растворяется в воде. Так при 20 °С массовая доля SO2 в насыщенном растворе достигает 10,3 %. При растворении он взаимодействует с водой с образованием гидрата SO2·nН2О. Его формулу чаще записывают как H2SO3. Полученный раствор называют также сернистой кислотой. Она является слабой кислотой. При взаимодействии с оксидами, гидроксидами и солями образует соли двух типов: средние, например Na2SO3 сульфит натрия, и кислые, например, NaHSO3 гидросульфит натрия.
Все соединения серы(IV) при взаимодействии с разными веществами проявляют как окислительные, так и восстановительные свойства.
Оксид серы(VI). Наряду с сернистым газом существует еще и оксид серы(VI) SO3. Его получают, окисляя кислородом оксид серы(IV) в присутствии катализатора (оксидов ванадия, или железа, металлической платины).
Оксид серы(VI) представляет собой жидкость без цвета и запаха. Она плавится при 16,8 °С, а кипит при 44,7 °С. Оксид серы(VI) является сильным окислителем, сам при этом восстанавливается до диоксида SO2. Он относится к кислотным оксидам. При взаимодействии с водой формируется гидрат, называемый серной кислотой H2SO4.
Оба оксида серы и сероводород входят в состав рудничного газа.
Вопросы для самопроверки
1. Вода: получение, структура, свойства и применение.
2. Оксиды углерода: получение, структура, свойства и применение.
3. Оксиды азота: состав, получение, структура, свойства и применение.
4. Сероводород и сероводородная кислота: получение, структура, свойства и применение.
5. Оксиды серы: состав, получение, структура, свойства и применение.
Дата добавления: 2015-09-21; просмотров: 956;
