Получение кислот
Для получения неорганических кислот используют реакции разных типов. Важнейшими из них являются:
1. Взаимодействие некоторых простых веществ-неметаллов с водородомв специальных условиях,например:
H2 + Cl2 = 2HCl; H2 + S = H2S.
водород хлор хлоро- водород сера серо-
водород водород
Образующиеся газообразные продукты реакций – HCl и H2S растворяют в воде и получают соответствующие бескислородные кислоты – хлороводородную и сероводородную. Таким же образом можно получить и бромоводородную кислоту – раствор газа бромоводорода HBr в воде.
2. Взаимодействие нелетучей безводной серной кислоты с твёрдыми солями.
Этот способ основан на том, что нелетучая серная кислота H2SO4 при нагревании вытесняет летучие кислоты – HCl и HNO3 из их твёрдых солей. Поэтому, например, хлороводородную кислоту можно получить, нагревая смесь её соли – твёрдого хлорида натрия с безводной серной кислотой:
2NaCl + H2SO4 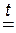 2HCl ↑ + Na2SO4;
2HCl ↑ + Na2SO4;
хлорид серная хлоро- сульфат
натрия кислота водород натрия
Газообразный хлороводород, выделяющийся в этой реакции, растворяют в воде и получают хлороводородную кислоту. Поскольку она образуется из хлорида натрия NaCl, называемого в быту просто «соль», то эту кислоту очень часто называют «соляная кислота».
Для получения азотной кислоты нагревают смесь её соли – нитрата натрия NaNO3 с безводной серной кислотой:
2NaNO3 + H2SO4 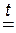 2HNO3↑ + Na2SO4;
2HNO3↑ + Na2SO4;
нитрат серная азотная сульфат
натрия кислота кислота натрия
Пары азотной кислоты, образующиеся в результате второй реакции, охлаждают до комнатной температуры, и она переходит в жидкое состояние.
3. Взаимодействие кислотных оксидов с водой.
Вы уже знаете, что кислотные оксиды, кроме SiO2, реагируют с водой с образованием кислот. Это свойство кислотных оксидов используют для получения некоторых кислородсодержащих кислот, например, серной и фосфорной:
SO3 + H2O = H2SO4; P2O5 + H2O = H3PO4.
оксид вода серная оксид вода фосфорная
серы(VI) кислота фосфора(V) кислота
Поскольку оксид кремния SiO2 с водой не реагирует, то соответствующую ему кислоту H2SiO3 получают другими способами.
Дата добавления: 2015-09-18; просмотров: 925;
