Номенклатура кислот. Кислотные остатки
Традиционные русские названия бескислородных кислот составляются в последовательности: «корень русского названия соответствующего галогена или халькогена» + «суффикс «о» + «водородная»: HF – фтороводородная, HCl – хлороводородная, HBr – бромоводородная, H2S – сероводородная. Кислота HCN имеет название «циановодородная».
Названия кислородосодержащих кислот производятся от русских названий кислотоообразующих элементов с различными суффиксами, которые необходимо строго выдерживать.
Если элемент образует две кислоты, то используются суффиксы -ни -ист: первый – при максимальной степени окисления кислотообразующего элемента, а второй – если степень окисления данного элемента ниже максимальной. Пример:
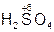 – серная кислота,
– серная кислота, 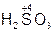 – сернистая кислота;
– сернистая кислота;
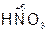 – азотная кислота,
– азотная кислота, 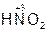 – азотистая кислота.
– азотистая кислота.
В названиях некоторых кислот суффикс -н заменяется суффиксами -ов и -ев: H2CrO4 – хромовая кислота, H2SiO3 – кремниевая кислота.
Галогены хлор, бром и иод, кроме бескислородных образуют по четыре кислородосодержащих кислоты, в которых степени окисления атомов галогенов равны +7, +5, +3 и +1. В названиях этих кислот используются соответственно суффиксы -н, -оват, -ист и -оватист: HClO4 – хлорная, HClO3 – хлорноватая, HClO2 – хлористая, HClO – хлорноватистая.
Существуют кислоты различного состава, в молекулах которого атомы элемента-кислотообразователя находятся в одной и той же степени окисления. В этом случае к названию кислоты с наименьшим содержанием атомов водорода и кислорода добавляется префикс (приставка) мета-, с наибольшим – орто-, а при промежуточном содержании атомов водорода и кислорода (в расчёте на один атом кислотообразуещего элемента) – пиро-: HPO3 – метафосфорная кислота, H3PO4 – ортофосфорная кислота, H4P2O7 – пирофосфорная кислота.
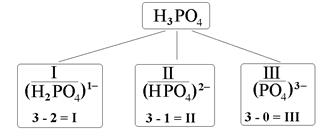 При отщеплении атомов водорода от молекул кислот образуются кислотные остатки. Общее число остатков кислоты совпадает с её основностью. Как вы уже знаете, валентность кислотного остатка равна разности между числами атомов H в формулах кислоты и данного остатка. Заряды кислотных остатков всегда отрицательны и численно совпадают с их валентностью. Например, фосфорной кислоте соответствуют три кислотных остатка – H2PO4, HPO4 и PO4, валентность которых равна, соответственно, I, II и III, а их заряды составляют 1–, 2– и 3– (рис. 2).
При отщеплении атомов водорода от молекул кислот образуются кислотные остатки. Общее число остатков кислоты совпадает с её основностью. Как вы уже знаете, валентность кислотного остатка равна разности между числами атомов H в формулах кислоты и данного остатка. Заряды кислотных остатков всегда отрицательны и численно совпадают с их валентностью. Например, фосфорной кислоте соответствуют три кислотных остатка – H2PO4, HPO4 и PO4, валентность которых равна, соответственно, I, II и III, а их заряды составляют 1–, 2– и 3– (рис. 2).
 Названия важнейших кислот и соответствующих кислотных остатков приведены в Приложении 1.
Названия важнейших кислот и соответствующих кислотных остатков приведены в Приложении 1.
Дата добавления: 2015-09-18; просмотров: 2729;
