Химические свойства. В водных растворах кислоты проявляют ряд схожих химических свойств, называемых кислотными свойствами:
В водных растворах кислоты проявляют ряд схожих химических свойств, называемых кислотными свойствами:
а) Э л е к т р о л и т и ч е с к а я д и с с о ц и а ц и я и и з м е н е н и е о к р а с к и и н д и к а т о р о в
По способности диссоциировать в водных растворах на ионы неорганические кислоты делятся на две группы:
· Сильные кислоты – HСlO4, HBrO4, HMnO4, H2SO4, H2SeO4, HNO3, HClO3, HBrO3, HIO3. В водных растворах они диссоциируют практически полностью и необратимо:
HСlO4 → H+ + СlO4–; H2SO4 → 2H+ + SO42–.
· Слабые кислоты – HClO, HBrO, HIO, HClO2, H2SO3, H2СO3, H2SiO3, H3PO4, H3BO3. В водных растворах они диссоциируют частично и обратимо. При этом диссоциация многоосновных кислот протекает ступенчато, например:
H3PO4 ↔ H+ + H2PO4–; H2PO4– ↔ H+ + HPO42–; HPO42– ↔ H+ + PO43–;
Поскольку в водных растворах всех кислот содержатся ионы водорода H+, они изменяют окраску индикаторов: лакмуса – с фиолетового на красный; метилоранжа – с оранжевого на красный; бесцветный фенолфталеин в присутствии кислот не изменяет свою окраску.
б) В з а и м о д е й с т в и е с м е т а л л а м и
В водных растворах многие кислоты реагируют с металлами, расположенными в ряду активности левее Н2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества – соли и выделяется газообразное простое вещество – водород:
| кислота | + | металл | = | СОЛЬ | + | ВОдород |
В такие реакции вступают как бескислородные (HCl, HBr), так и кислородсодержащие (H2SO4, H3PO4) кислоты, например:
2HCl + Zn = ZnCl2 + H2↑; H2SO4 + Mg = MgSO4 + H2↑;
хлорово- цинк хлорид водород серная магний сульфат водород
дородная цинка кислота магния
кислота
6HBr + 2Al = 2AlBrl3 + 3H2↑; H2SO4 + Fe = FeSO4 + H2↑.
бромо- алюми- бромид водород серная железо сульфат водород
дородная ний алюминия кислота железа(II)
кислота
Реакции этого типа относятся к реакциям замещения: атомы металлов замещают (вытесняют) атомы водорода из молекул кислот.
Следует помнить, что металлы, расположенные в ряду активности правее Н2 (Сu, Ag, Hg и др.) с указанными кислотами в водных растворах не реагируют.
в) Р е а к ц и и с о с н о в н ы м и о к с и д а м и
Кислоты реагируют с основными оксидами, образуя соли и воду:
| кислота | + | ОСНОВНЫЙ ОКСИД | = | СОЛЬ | + | ВОДА |
Следует помнить, что в образующейся соли степень окисления металла такая же, как в исходном оксиде. Примеры реакций:
2 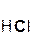 +
+ 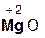 =
= 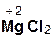 + H2O;
+ H2O;
хлорово- оксид хлорид вода
дородная магния магния
кислота
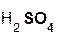 +
+ 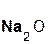 =
= 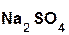 + H2O;
+ H2O;
серная оксид сульфат вода.
кислота натрия натрия
Эти реакции относятся к реакциям обмена, поскольку в процессе взаимодействия исходные сложные вещества обмениваются своими составными частями.
г) В з а и м о д е й с т в и е с о с н о в а н и я м и
Кислоты реагируют с основаниями по общей схеме:
| кислота | + | ОСНОВание | = | СОЛЬ | + | ВОДА |
Кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями, например:
2 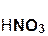 +
+ 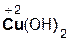 =
= 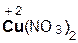 + 2H2O;
+ 2H2O;
азотная гидроксид нитрат вода
кислота меди(II) меди(II)
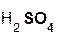 + 2
+ 2 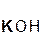 =
= 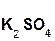 + 2H2O;
+ 2H2O;
серная гидроксид сульфат вода
кислота калия калия
Реакции этого типа, как и предыдущего, относятся к реакциям обмена.
г) В з а и м о д е й с т в и е с с о л я м и
Ещё один класс сложных веществ, с которыми кислоты могут вступать в химическое взаимодействие, – соли. Реакции этого типа идут согласно общей схемы:
| кислота | + | соль | = | новая кислота | + | новая соль |
Однако сразу заметим, что кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Примеры таких реакций:
2 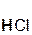 +
+ 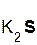 =
= 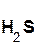 ↑ + 2
↑ + 2 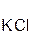 ;
;
хлоро- сульфид серо- хлорид
водородная калия водород калия
кислота
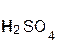 +
+ 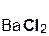 = 2
= 2 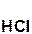 +
+ 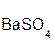 ↓.
↓.
серная хлорид хлоро- сульфат
кислота бария водородная бария
кислота
Очевидно, что реакции этого типа, как и двух предыдущих, относятся к реакциям обмена.
д) Р а з л о ж е н и е к и с л о т н а к и с л о т н ы е о к с и д ы и в о д у
Известно несколько кислот, которые достаточно легко разлагаются на соответствующий кислотный оксид и воду. К таким кислотам, называющимся неустойчивыми, относятся, например, угольная (H2CO3), сернистая (H2SO3) и кремниевая (H2SiO3) кислоты. Особенно неустойчива угольная кислота: она разлагается на кислотный оксид CO2 и воду уже при комнатной температуре:
H2CO3 = CO2 + H2O.
угольная оксид вода
кислота углерода(IV)
По этой причине угольная кислота, образующаяся в результате реакций обмена, сразу же разлагается на указанные вещества, например:
 CO2 ↑ (оксид углерода(IV)
CO2 ↑ (оксид углерода(IV)
 CaCO3 + 2HCl = CaCl2 + H2CO3
CaCO3 + 2HCl = CaCl2 + H2CO3
карбонат хлоро- хлорид угольная H2O (вода).
кальция водородная кальция кислота
кислота
Сернистая и кремниевая кислоты разлагаются на кислотные оксиды и воду при нагревании:
H2SO3 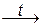 SO2 + H2O; H2SiO3
SO2 + H2O; H2SiO3 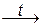 SiO2 + H2O.
SiO2 + H2O.
сернистая оксид кремниевая оксид
кислота серы(IV) кислота кремния(IV)
Дата добавления: 2015-09-18; просмотров: 1739;
