Свойства оснований
Физические свойства. Все основания – белые или окрашенные в различные цвета твёрдые вещества. Щёлочи, за исключением гидроксида кальция, хорошо растворимы в воде. Гидроксиды щелочных металлов гигроскопичны: притягивая из воздуха влагу, они постепенно «расплываются».
Химические свойства.
а) Э л е к т р о л и т и ч е с к а я д и с с о ц и а ц и я и д е й с т в и е н а
и н д и к а т о р ы.
Все щёлочи – сильные электролиты, относящиеся к сильным основаниям. В водных растворах они необратимо и полностью диссоциируют на ионы:
NaOH → Na+ + OH– ; Ba(OH)2 → Ba2+ + 2OH–.
Наличие в растворах щелочей гидроксид-ионов OH– обусловливает их общие свойства. Так, например, растворы всех щелочей скользкие на ощупь, едкие, разрушают кожу и ткани. Они изменяют окраску индикаторов: лакмуса с фиолетовой на синюю, метилоранжа – с оранжевой на жёлтую, фенолфталеина – с бесцветной на малиновую.
Гидрат аммиака NH3 · H2O («гидроксид аммония NH4OH») – слабый электролит, диссоциирующий в растворах обратимо и частично:
NH3 · H2O ↔ NH4+ + OH–.
Вследствие этого в растворах данного основания, в отличие от щелочей, концентрация ионов OH– невелика, однако она достаточна для изменения окраски индикаторов.
б) В з а и м о д е й с т в и е с к и с л о т а м и.
Практически все основания реагируют с кислотами с образованием солей по общей схеме:
| ОСНОВание | + | кислота | = | СОЛЬ | + | ВОДА |
В образующейся соли степень окисления металла такая же, как в исходном основании, а заряд кислотного остатка такой же, как в исходной кислоте.
Примеры реакций, протекающих в соответствии с указанной схемой:
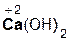 + 2
+ 2 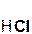 =
= 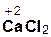 + 2H2O;
+ 2H2O;
гидроксид хлорово- хлорид вода
кальция дородная кальция
кислота
2 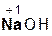 +
+ 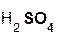 =
= 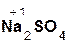 + 2H2O;
+ 2H2O;
гидроксид серная сульфат вода.
натрия кислота натрия
В результате реакции между щёлочью и кислотой образуется раствор соли, в котором уже нет ни щёлочи, ни кислоты. Такой раствор называется нейтральным. Слово «нейтральный» происходит от греческого «нейтер», что в переводе на русский язык значит «ни тот, ни другой».
Реакция между щёлочью и кислотой, в результате которой образуется нейтральный раствор, называется реакцией нейтрализации.
в) В з а и м о д е й с т в и е с к и с л о т н ы м и о к с и д а м и.
Все щёлочи реагируют с кислотными оксидами по общей схеме:
| ЩЁЛОЧЬ | + | КИСЛОТНЫЙ ОКСИД | = | СОЛЬ | + | ВОДА |
В состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3(указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. CO3:
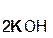 +
+ 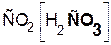 =
= 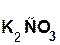 + H2O.
+ H2O.
гидроксид оксид карбонат вода
калия углерода(IV) калия
Если же в реакцию вступает кислотный оксид P2О5, которому соответствует кислота H3PO4 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. PO4 с валентностью, равной III:
3 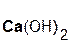 +
+ 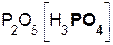 =
= 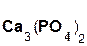 + 3H2O.
+ 3H2O.
гидроксид оксид фосфат вода
кальция фосфора(V) кальция
г) В з а и м о д е й с т в и е с с о л я м и.
Все щёлочи реагируют с солями по общей схеме:
| ЩЁЛОЧЬ | + | соль | = | НОВОЕ ОСНОВАНИЕ | + | НОВАЯ СОЛЬ |
Реакции этого типа относятся к реакциям обмена, поскольку в процессе взаимодействия исходные вещества – щёлочь и соль – обмениваются своими составными частями.
В результате таких реакций обычно выпадает осадок (↓) какого-либо одного нового вещества, например:
2KOH + CuSO4 = Cu(OH)2↓ + K2SO4;
гидроксид сульфат гидроксид сульфат
калия меди(II) меди(II) калия
Ca(OH)2 + K2CO3 = 2KOH + Ca CO3↓.
гидроксид карбонат гидроксид карбонат
кальция калия калия кальция
д) Т е р м и ч е с к о е р а з л о ж е н и е.
Все нерастворимые основания при нагревании разлагаются по общей схеме:
| нерастворимое основание | 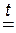
| ОКСИД металла | + | ВОДА |
Примеры реакций:
Сu(OH)2 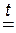 CuO + H2O; 2Fe(OH)3
CuO + H2O; 2Fe(OH)3 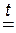 Fe2O3 + 3H2O
Fe2O3 + 3H2O
гидроксид оксид гидроксид оксид
меди(II) меди(II) железа(III) железа(III).
Амфотерныеоснования обладают свойствами как типичных оснований, так и кислот, т. е. они взаимодействуют и с кислотами, и со щелочами. В обоих случаях образуется соль и вода. Например, амфотерный гидроксид цинка взаимодействует с соляной кислотой согласно уравнению:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
При взаимодействии этого гидроксида с расплавленной щелочью образуется цинкат – соль несуществующей «цинковой кислоты» H2ZnO2 (это – формула гидроксида цинка Zn(OH)2, записанная в виде кислоты: Zn(OH)2 = H2ZnO2). Поэтому уравнение данной реакции имеет вид:
Zn(OH)2 + 2NaOH (распл) 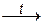 Na2ZnO2 + 2H2O.
Na2ZnO2 + 2H2O.
Если же амфотерный гидроксид реагирует со щёлочью не в расплаве, а в водном растворе, то в результате реакции образуется комплексное соединение:
Zn(OH)2 + 2NaOH = (Na2ZnO2 · 2H2O) = Na2[Zn(OH)4].
Так же взаимодействуют с кислотами и щелочами амфотерные гидроксиды бериллия, олова(II) и свинца(II).
Амфотерный гидроксид алюминия реагирует с азотной кислотой согласно уравнению:
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O.
При взаимодействии этого гидроксида с расплавленной щелочью могут образоваться соли несуществующих «алюминиевых кислот» H3AlO3 и HAlO2 – соответственно ортоалюминаты и метаалюминаты. Поэтому уравнения указанных реакций имеют вид:
Al(OH)3 + 3NaOH (распл) 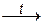 Na3AlO3 + 3H2O;
Na3AlO3 + 3H2O;
Al(OH)3 + NaOH (распл) 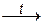 NaAlO2 + 2H2O;
NaAlO2 + 2H2O;
При взаимодействии гидроксида алюминия со щёлочью в водном растворе образуются комплексные соединения:
Al(OH)3 + 3NaOH = (Na3AlO3 · 3H2O) = Na3[Al(OH)6];
Al(OH)3 + NaOH = (NaAlO2 · 2H2O) = Na[Al(OH)4].
Амфотерные гидроксиды взаимодействуют как с кислотными, так и с оснóвными оксидами с образованием солей:
2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O; 3Zn(OH)2 + P2O5 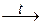 Zn3(PO4)2 + 3H2O;
Zn3(PO4)2 + 3H2O;
2Al(OH)3 + Na2O 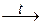 2NaAlO2 + 3H2O; Be(OH)2 + CaO
2NaAlO2 + 3H2O; Be(OH)2 + CaO  CaBeO2 + H2O.
CaBeO2 + H2O.
Дата добавления: 2015-09-18; просмотров: 1134;
