Получение оснований
Поскольку растворимые и нерастворимые основания отличаются между собой по свойствам, эти вещества получают разными способами.
Получение щёлочей
Для получения щёлочей можно использовать следующие реакции:
а) Взаимодействие активных металлов (Li, Na, Ca, Ba) с водой, например:
2Li + 2H2O = 2LiOH + H2↑; Ca + 2H2O = Ca(OH)2 + H2↑;
литий вода гидроксид водород кальций вода гидроксид водород
лития кальция
Поскольку эти реакции протекают бурно, на практике их используют редко.
б) Взаимодействие оксидов указанных металлов с водой:
Li2O + 2H2O = 2LiOH; CaО + H2O = Ca(OH)2.
оксид вода гидроксид оксид вода гидроксид
лития лития кальция кальция.
в) Взаимодействие некоторых солей щелочных металлов с щелочами, например:
Na2СO3 + Cа(OH)2 = 2NaOH + CaCO3↓.
карбонат гидроксид гидроксид карбонат
натрия кальция натрия кальция
г) Электролиз водных растворов солей
Некоторые щёлочи (NaOH, KOH) получают, пропуская электрический ток через водные растворы солей NaCl или KCl. При этом наряду со щёлочами образуются и другие ценные вещества – водород H2 и хлор Сl2:
2NaCl + 2H2O 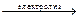 2NaOH + H2↑ + Cl2↑.
2NaOH + H2↑ + Cl2↑.
Получение нерастворимых оснований
Нерастворимые основания получают взаимодействием растворимых оснований (щёлочей) с солями, например:
NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4;
гидроксид сульфат гидроксид сульфат
натрия меди(II) меди(II) натрия.
3KOH + FeCl3 = Fe(OH)3↓ + 3KCl.
гидроксид хлорид гидроксид хлорид
калия железа(III) железа(III) калия.
Если получаемое этим способом основание является амфотерным, оно взаимодействует с избытком щёлочи. Поэтому в таком случае вместо щелочей используют водный раствор аммиака, с которым амфотерное основание не реагирует:
3NH3 · H2О + AlCl3 = Al(OH)3¯ + 3NH4Cl
гидрат хлорид гидроксид хлорид
аммиака алюминия алюминия аммония
Дата добавления: 2015-09-18; просмотров: 904;
