Химические свойства. Для большинства солей характерны реакции замещения и обмена, а для некоторых – ещё и реакции разложения.
Для большинства солей характерны реакции замещения и обмена, а для некоторых – ещё и реакции разложения.
1. Р е а к ц и и с м е т а л л а м и
Соли реагируют с металлами по общей схеме:
| соль | + | металл | = | новый металл | + | НОВАЯ СОЛЬ |
При этом всегда более активный металл, расположенный в ряду активности левее, вытесняет из соли менее активный металл, который расположен в этом ряду правее. Для написания уравнений реакций данного типа полезно запомнить хорошее правило: «Металл, который в ряду активности находится левее, записываем в левой части, а металл, расположенный правее – в правой части уравнения».
Примеры реакций:
3CuCl2 + 2Al = 3Cu↓ + 2AlCl3; 3AgNO3 + Fe = 3Ag↓ + Fe(NO3)3.
хлорид алюми- медь хлорид нитрат железо серебро нитрат
меди(II) ний алюминия серебра железа(III)
Очень часто образующиеся в этих реакциях менее активные металлы осаждаются на поверхности оставшихся более активных металлов в виде рыхлой корочки. Однако, если менее активным металлом является жидкая ртуть, она выделяется в виде сплошной блестящей плёнки.
2. Р е а к ц и и с к и с л о т а м и
В водных растворах соли реагируют с кислотами по общей схеме:
| соль | + | кислота | = | новая соль | + | новая кислота |
Следует помнить, что соль реагирует в растворе с кислотой лишь в том случае, если в результате реакции образуется нерастворимое вещество, выпадающее в осадок (↓), или выделяется газ (↑). Примеры реакций:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl;
хлорид серная сульфат хлоро-
бария кислота бария водородная
кислота
K2S + 2HCl = 2KCl + H2S↑
сульфид хлоро- хлорид серо-
калия водородная калия водород.
кислота
Реакции этого типа относятся к реакциям обмена, поскольку участвующие в них исходные вещества обмениваются своими составными частями.
3. Р е а к ц и и со щ ё л о ч а м и.
В водных растворах соли реагируют с щёлочами по общей схеме:
| соль | + | ЩЁЛОЧЬ | = | НОВАЯ СОЛЬ | + | НОВОЕ ОСНОВАНИЕ |
В результате этих реакций обычно выпадает осадок (↓) какого-либо одного нового вещества, например:
FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2↓;
cульфат гидроксид сульфат гидроксид
железа(II) натрия натрия железа(II)
Na2СO3 + Cа(OH)2 = CaCO3↓ + 2NaOH.
карбонат гидроксид карбонат гидроксид
натрия кальция кальция натрия
4. Р е а к ц и и с д р у г и м и с о л я м и.
Соли в водных растворах вступают в реакции обмена с другими солями по общей схеме:
| соль | + | соль | = | новая соль | + | новая соль |
Следует помнить, что соль реагирует с другой солью лишь в том случае, если в результате реакции образуется осадок (↓) одной или двух новых солей:
СaCl2 + Na2CO3 = CaCO3↓ + 2NaCl;
хлорид карбонат карбонат хлорид
кальция натрия кальция натрия.
CuSO4 + BaS = CuS↓ + BaSO4↓.
сульфат сульфид сульфид сульфат
меди(II) бария меди(II) бария.
5. Т е р м и ч е с к о е р а з л о ж е н и е.
Соли некоторых кислородсодержащих кислот разлагаются с образованием основного и кислотного оксидов по общей схеме:
| соль | 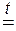
| ОСНОВНЫЙ ОКСИД | + | КИСЛОТНЫЙ ОКСИД |
В ходе таких реакций всегда образуется газообразный кислотный оксид. Он соответствует той кислоте, остаток которой содержится в исходной соли. например, при разложении соли, содержащей остаток угольной кислоты, образуется соответствующий ей кислотный оксид:
CaCO3 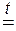 CaO + CO2↑
CaO + CO2↑
карбонат оксид оксид
кальция кальция углерода(IV)
По приведенной схеме разлагаются и некоторые соли сернистой кислоты H2SO3, которой соответствует кислотный оксид SO2:
BaSO3 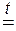 BaO + SO2↑;
BaO + SO2↑;
сульфит оксид оксид
бария бария серы(IV)
Дата добавления: 2015-09-18; просмотров: 880;
