Определение и классификация солей
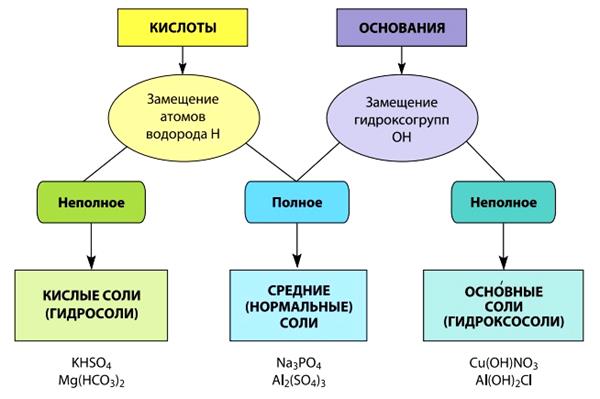 |
Соли можно рассматривать как продукты замещения атомов водорода в кислотах атомами металлов или групп ОН в основаниях кислотными остатками. В зависимости от степени замещения атомов водорода в молекулах кислот или гидроксогрупп ОН в формульных единицах оснований соли классифицируются следующим образом (рис. 4):
Рис. 4. Схема образования и классификации солей
Поскольку соли можно получать взаимодействием оснований с кислотами, в состав любой из солей входят основные и кислотные остатки. Поэтому можно сказать, что соли – сложные вещества, состоящие из основных и кислотных остатков.
Средние (нормальные) соли образуются при полном замещении атомов водорода в молекулах кислот атомами металлов, например:
H2SO4 + 2NaOH = Na2SO4 + 2H2O; H3PO4 + 3KOH = K3PO4 + 3H2O.
Кислые соли образуются при неполном замещении атомов водорода в молекулах кислот атомами металлов, например:
H2SO4 + NaOH = NaHSO4 + H2O; H3PO4 + KOH = KH2PO4 + H2O;
H3PO4 + 2KOH = K2HPO4 + 2H2O.
В кислотных остатках кислых солей всегда содержатся атомы водорода. Очевидно, что кислые соли образуются только многоосновными кислотами.
Оснóвные соли образуются при неполном замещении гидроксогрупп ОН в формульных единицах оснований кислотными остатками, например:
Al(OH)3 + HCl = Al(OH)2Cl + H2O; Al(OH)3 + 2HCl = AlOHCl2 + 2H2O.
Основные остатки, входящие в состав основных солей, содержат группы ОН. Очевидно, что такие соли образуются только многокислотными основаниями.
По способности растворяться в воде все соли делятся на две большие группы – растворимые и нерастворимые соли. Примеры солей каждой из этих групп приведены на следующей схеме:
| С о л и | ||

| 
| |
| Растворимые | Нерастворимые | |
| NaCl, KBr, KNO3, MgSO4, Na2CO3, ZnSO4, K2S, Al(NO3)3, K2SO3, CaCl2. | BaSO4, CaCO3, AgCl, CuS, MgSiO3, PbSO4, Ca3(PO4)2. |
Дата добавления: 2015-09-18; просмотров: 2150;
